전이성대장암환자에서 체외 항암약물 감수성 검사와 일차항암화학요법 간의 임상적 연관성
Clinical correlation between in vitro chemoresponse assay and first line chemotherapy for metastatic colorectal cancer patients
Article information
Trans Abstract
Purpose:
The study investigated correlations between adenosine triphosphate-based chemotherapy response assay (ATP-CRA) and clinical response after first line chemotherapy for metastatic colorectal cancer patients.
Methods:
From June 2009 to June 2012, 24 patients were enrolled in this study. ATP-CRA was performed to evaluate the chemosensitivities of three combination anticancer drugs such as 5-fluorouracil (FU)+oxaliplatin and irinotecan, and capecitabine+oxaliplatin for metastatic colorectal cancer. A sensitive group (SG) and resistant group (RG) for chemotherapy regimen (oxaliplatin+5-FU+leucovorin [FOLFOX], n = 14; oxaliplatin+capecitabine [CapeOx], n = 2; irinotecan+5-FU+leucovorin [FOLFIRI], n = 8) was defined as cut-off value 30%. The outcomes were a correlation between the ATP-CRA results and the clinical response and progression-free survival.
Results:
Patients were dichotomized into the SG (19 patients) and RG (5 patients) groups. There was no difference between groups, in terms of regimen, frequency and interval of chemotherapy. The disease control rate after first response evaluation was not shown statistically difference (89.5% in SG and 60.0% in RG, respectively, P = 0.15). And there was also no significance in second and third response evaluation. The median progression-free month were 7.0 (range, 2–27 month) and 5.0 (range, 3–12 month), respectively and shown marginal significance. However, there was no statistical difference in progression-free survival curve (P = 0.16). Sensitivity, specificity, positive prediction rate and negative prediction rage for disease control after first response was 85.0%, 50.0%, 89.5%, and 40.0%.
Conclusion:
Although ATP-CRA may be helpful in predicting chemotherapy response in metastatic colorectal cancer, there was not conclusive. Therefore, we recommend further clinical studies to confirm the efficacy of chemoresponse assay for metastatic colorectal cancer.
서 론
대장암의 예후에 가장 중요한 것은 원격 전이의 진행이며, 최초 진단 시 약 15%–20% 그리고 완치 수술 후 30%–50%에서 원격전이가 나타난다. 전이성 대장암 치료에는 항암화학요법이 가장 중요하며 치료에 대한 우수한 반응은 환자의 생존율과 삶의 질을 증가시킨다[1]. 항암화학요법은 전이 병소의 크기와 수를 줄여 종양의 진행을 억제할 뿐 아니라 절제가 불가능한 전이 병소를 절제 가능한 상태로 만들어 줄 수 있다[2]. 항암화학요법 후 우수한 치료 반응뿐 아니라 전이 병소가 완전히 절제될 경우 전이성 대장암 환자에서 생존율을 가장 증가시킬 수 있으며, 전이성 간종양 절제수술 후 약 50%의 5년 생존율까지도 보고된다[3,4]. 전이성 대장암의 항암화학요법에는 oxaliplatin 혹은 irinotecan과 5-fluorouracil (FU) 제제가 병합되는 3제 병합요법이 주로 이용되며, 치료 반응률은 39%–50%로 보고된다[5,6]. 그러나 항암화학요법 치료는 종양 반응뿐 아니라 부작용 역시 나타나고, 동일한 약제에 환자 개개인의 반응이 다양하므로 항암화학요법 시행 전에 우수한 결과 미리 예측이 가능하다면 항암화학요법을 효율적으로 시행할 수 있을 것이다.
항암약물 감수성 검사는 종양의 치료에 사용될 수 있는 항암약물을 체외 배양된 환자의 종양세포와 미리 반응시킴으로써 각각 항암약물에 대한 종양의 사멸 정도를 미리 알 수 있는 방법이다. 지금까지 항암약물 감수성 검사는 세포 증식상태, 효소 활성상태 또는 세포내 ATP함량 계측에 의한 세포사멸상태를 확인하는 법 등 다양한 방법이 시행되고 있다[7-11]. Adenosine triphosphate (ATP) 이용 항암약물 감수성 검사법은 다른 검사들과 비교해 비교적 쉽게 암세포와 정상세포를 구별해내고 적은 양의 검체로도 배양 성공률이 높고, 세포 생존 상태를 더 예민하게 측정할 수 있는 방법이다. ATP 이용 항암약물 감수성 검사는 검사 성공률과 재현성 그리고 비교적 빠른 기간 안에 검사결과를 확인할 수 있는 방법으로 다양한 암종에서 연구가 시행되었다[12].
지금까지 다양한 방법에 의한 항암약물 감수성 상태와 항암화학요법 후 임상적 반응성 및 유용성에 대한 연구가 시행되었으나 제한적인 환자수 및 일관되지 않은 결과 그리고 무작위 연구의 부재 등으로 임상적 효용성에 대해서는 아직 결론을 내리기 어렵다. ATP이용 항암약물 감수성 검사를 통한 연구는 난소암, 위암, 폐암 그리고 유방암 등을 대상으로 시행되었으며 항암약물 민감도에 따라 임상적 반응을 비교적 잘 예측할 수 있음을 몇몇 연구에서 보고하였다[13-17]. 또한 대장암을 대상으로 시도된 연구도 드물게 보고되었으며 ATP 이용 항암약물 감수성 검사가 임상적 유용할 수 있음을 보고하였다[18,19].
본 연구는 간 및 폐전이를 가진 전이성 대장암에서 일차성 항암화학요법을 받은 환자들을 대상으로 체외 ATP 이용 항암약물 감수성 결과와 임상적 치료 반응과 연관성이 있는지 알아보고자 하였다.
방 법
2009년 6월부터 2012년6월까지 원발성 대장 샘암종으로 진단받은 환자 중 측정 가능한 동시성 간과 폐전이가 확인된 4기 대장암환자에서 체외 ATP 이용 항암약물 감수성 검사 결과가 확인된 환자를 대상으로 하였다. 5년 이내 타 암종으로 진단받고 항암약물요법이 시행된 환자는 대상에서 제외되었다. 임상적으로 항암화학요법이 시행 가능한 전신상태 및 혈액학적 소견을 보이는 75세 미만의 환자로 최소 2주기 이상 임상적 반응평가가 시행된 환자가 포함되었다. 항암약물 감수성 검사는 ATP 함량 계측으로 세포사멸상태를 확인하는 방법(adenosine-triphosphate based chemoresponse assay, ATP-CRA)을 외부기관에 의뢰해 시행되었다. 의무기록과 검사의뢰 결과를 분석한 결과 대상 환자군 29예 중 24예(82.7%)에서 최종 연구에 대상이 되었다.
체외ATP 이용 항암약물 감수성 검사(in vitro ATP based chemoresponse assay)
종양조직은 수술직후 신선한 상태에서 병리과 의사가 채취하여, 채취된 조직은 Hank’s balanced salt 용액(HBSS, Gibco, Rockville, MD, USA)에 넣어져 저온상태(4°C)에서 보관하였다. 보관된 조직은 24시간 이내 이수 앱지스(Isu Abxis Co., Ltd. Seoul, Korea)로 보내 항암제 감수성 검사를 시행하였다. 수술 전 방사선 치료가 시행된 환자에서는 방사선 치료 전 구불결장경검사로 획득한 종양조직으로 항암제 감수성 검사를 시행하였다. 암세포 없이 배지만 분주한 well을 음성 대조군으로, 암 조직에서 분리한 세포 1,000개에서 측정되는 ATP 함량의 최소 값과 평균 값에 해당하는 ATP를 각각 양성 대조군으로 포함하였다. 각 항암제의 cell death rate (CDR)은 측정된 발광값을 통해 계산하였다.
측정된 발광은 ATP의 양과 직접적인 관계가 있으며 대조군과 비교하여 세포사멸 정도를 퍼센트로 계산할 수 있었다. Intra-assay mean coefficient of variation (CV)는 매 검체마다 3번 측정하여 계산하었다. ATP-CRA를 시행한 항암약물로는 5-FU, oxaliplatin, irinotecan, capecitabine의단독약물과, oxaliplatin+5-FU, oxaliplatin+capecitabine irinotecan+5-FU의 복합제제였다[20].
항암화학요법
항암화학요법은 원발암 절제 수술 후 4–5주 이내 시행하였다. 사용된 항암화학요법제제는 oxaliplatin+5-FU+leucovorin (FOLFOX4), oxaliplatin+capecitabine (CapeOx) 그리고 irinotecan+5-FU+leucovorin (FOLFIRI)의 2제 혹은 3제 병합요법이 시행되었다. FOLFOX4는 oxaliplatin 85 mg/m2 1–2시간 정주, leucovorin 200 mg/m2 급속정주, 5-FU 400 mg/m2 급속 정주한 후 600 mg/m2를 22시간 동안 연속 정주하는 방법으로 다음날 oxaliplatin을 제외한 나머지 약제를 동일한 방법으로 정주하였으며 2주 간격으로 시행되었다. FOLFIRI는 irinotecan 180 mg/m2 1–2시간 정주, leucovorin 200 mg/m2 급속정주, 5-FU 400 mg/m2 급속 정주한 후 600 mg/m2를 22시간 동안 연속 정주하는 방법으로 다음날 irinotecan을 제외한 나머지 약제를 동일한 방법으로 정주하였으며 2주 간격으로 시행되었다. CapeOX는 는 oxaliplatin 130 mg/m2 1–2시간정주그리고 capecitabine은하루동안 2,000 mg/m2를 두 번으로 나누어 14일 동안 복용한 후 7일간 휴식기간을 거치는 3주 간격으로 8회 시행되었다.
항암화학요법 후 반응평가를 위해 약물 투여 2–3개월 이내 컴퓨터단층촬영(computed tomography, CT)과 혈액 carcinoembryonic antigen (CEA, ng/mL)를 시행하였다. 최소 15 mm 크기 이상의 병변이 해당되었으며, 최대 5개까지 가장 큰 병소의 최대직경을 측정하였다. 평가 기준은 Response Evaluation Criteria In Solid Tumors (RECIST) ver. 1.1을 적용하였으며, 완전관해(complete remission)는 모든 전이 병소가 영상학적으로 확인되지 않는 경우, 부분반응(partial response)은 새로운 병소 없이 최초 측정한 최대직경의 합이 최소 30% 감소한 경우, 진행성 질환(progressive disease)는 새로운 병소가 나타나거나 최초 측정한 최대직경의 합이 20% 이상이 경우, 안정적 질환 (stable disease)는 부분반응이나, 진행성질환에 해당되지 않는 경우였다[21].
통계 분석
항암약물에 대한 세포사멸률(cell death rate, CDR)을 측정한 후 항암약물 농도 1배(treated drug concentration×1)에서 CDR 30% 이상을 항암약물 민감군(sensitive group), 미만을 항암약물 저항군(resistant group)으로 나누었다[22]. 전이병소들의 최대직경 감소율과 혈액내 CEA 감소율을 계산하였으며, RECIST 기준에 의해 완전관해, 부분반응, 안정적 질환을 보일 경우 질환 조절군(disease control group)으로 하였다. 민감도, 특이도, 양성예측도 및 음성예측도를 평가하였다. 질환의 진행무병생존(progression-free survival)을 평가 하였다. 진행무병생존은 일차성 항암화학요법 후 질환의 진행이나 사망한 경우로 하였다. 통계 분석을 위해 PASW for Windows (ver. 18.0; SPSS Inc., Chicago, IL, USA)을 사용하였다. 범주형 변수는 chi-square test, 연속형 변수는 one-sample T-test, independent T-test를 사용하였으며, 생존분석은 Kaplan-Meier curve로 Log-rank test를 사용하였다. P-value < 0.05를 통계적으로 유의하다고 판정하였다.
결 과
환자 특성
24예의 전이성 대장암환자중 남자와 여자가 각각 19예와 5예, 평균 나이는 61세(범위, 38–70세)였다(Table 1). 3예는 수술 전 5-FU를 이용한 방사선항암치료 및 원발암 절제 이후 전이성 암종에 대한 일차성 항암화학요법이 시행되었다. 좌측 및 우측 결장암 그리고 직장암이 각각 11명, 4명 그리고 9명이었다. 22예에서 저분화 및 중분화 샘암종이었다. 일차성 항암화학요법제제는 FOLFOX 14예, CapeOX 2 예 그리고 FOLFIRI가 8예였다. 원격전이 병소는 간전이가 20예, 폐전이가 4예였다. 이중 7예는 대동맥주위 림프절 전이가 3예, 복막전이가 4예였다. 원격전이병소 개수는 2예는 단일 전이병소 나머지 22 예는 2개 이상의 다발성 전이병소를 가졌다.
체외 항암약물 감수성 검사
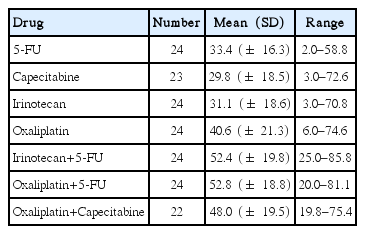
5-FU, capecitabine, irinotecan, oxaliplatin 단일제제와 5-FU와 irinotecan과 oxaliplatin 그리고 capecitabine과 oxaliplatin 병합제제에 대해 항암약물 감수성 검사가 보고되었다. 각 항암약물에 대한 종양세포의 평균 세포사멸률은 단일제제에 비해 복합제제에서 유의하게 높았다(Table 2). 세포사멸률 30%를 기준으로 한 복합제제에 대한 항암약물 민감도군은 5-FU+oxaliplatin 21예(87.5%), capecitibine+oxaliplatin 14예 (58.3%) 그리고 5-FU+irinotecan이 20예(83.3%)였다. 그리고 24예 중 17예(70.8%)는 5-FU+oxaliplatin과 5-FU+irinotecan에 대해 모두 세포사멸률이 30% 이상으로 나타났고, 5예는 1가지 복합제제에 대해서만 세포사멸률이 30% 이상, 나머지 2예는 두 가지 복합제제 모두에서 세포사멸률이 30% 미만이었다.
일차성 항암화학요법
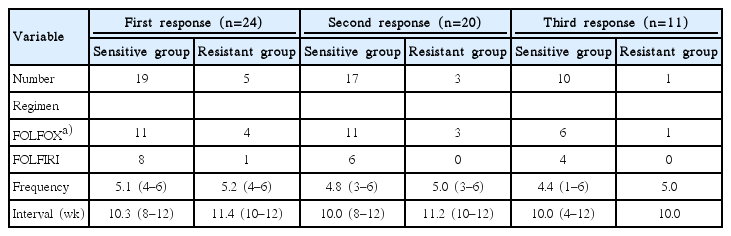
24예의 일차성 항암화학요법이 시행된 환자에서 세포사멸률 30%를 기준으로 항암약물 민감군과 저항군은 각각 19예와 5예였다. 항암화학요법제제는 항암약물 민감군이 FOLFOX (CapOX 2예)와 FOLFIRI가 각각 11예와 8예, 저항군이 FOLFOX와 FOLFIRI가 각각 4예와 1예였다(Table 3). 1주기 치료 후 반응평가까지 항암약물 평균 투여횟수는 민감군과 저항군에서 각각 5.1회(범위, 4–6회)와 5.2회(범위, 4–6회)로 차이가 없으며(P = 0.73), 반응평가 기간 역시 양군에서 각각 10.3주(범위, 8–12주)와 11.4주(범위, 10–12주)로 차이가 없었다(P = 0.12). 1주기 항암화학요법 후 FOLFOX약물이 투여된 민감군 2예에서 부분 반응 후 각각의 간전이(2곳)와 폐전이(2곳)가 완전절제가 시행되었다. 1주기 치료 후 진행성 질환(progressive disease)으로 확인된 4예(FOLFOX 1예, FOLFIRI 3예)를 제외한 나머지 20예에서 동일제제로 2주기 치료가 시행되었다. 2주기 치료 후 반응평가까지 항암약물 평균 투여횟수와 평가 기간 역시 각각 양군 간 차이는 없었다(P = 0.64, P = 0.25). 2주기 치료 후 FOLFOX 치료가 시행된 민감군 1예에서 2회 부분 반응으로 다발성 간전이(5곳) 병소에 대해 완전절제가 시행되었다. 2주기 반응평가 후 진행성 질환 5예와 부분 반응 4예(부작용 중단 2예, 수술 후 중단 1예, 방사선 치료 1예)를 제외한 나머지 11예에서 3주기 항암화학요법이 시행되었다. 3주기 반응평가까지 항암화학요법 평균 투여횟수와 반응평가 기간 역시 양 군 간 차이는 없었다(P = 0.73, P = 1.00). 그리고 3주기 평가 후 FOLFIRI치료가 시행된 민감군의 2예에서 다발성 간전이(6곳) 병소와 간 및 폐전이(4곳) 병소에 대해 완전 절제술이 시행되었다.
일차성 항암화학요법 후 체외 항암약물 감수성에 따른 양군의 임상적 반응
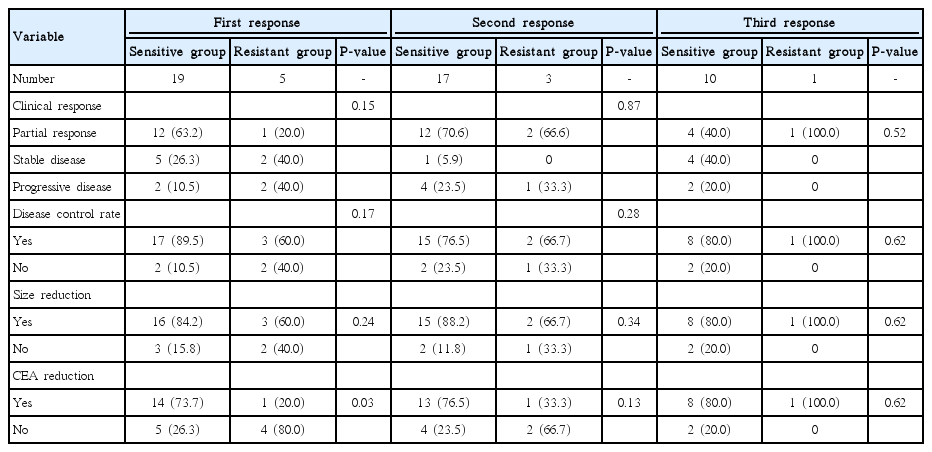
동일한 일차성 항암화학요법에 대해 3주기 투여 후 총 3차례 반응평가가 시행되었다(Table 4). 그리고 각 치료 주기에 따른 임상적 반응평가 결과는 그림으로 제시하였으며, 완전관해를 보인 경우는 없었다(Fig. 1). 1주기반응평가에서부분반응이민감군에서 12예(63.2%)로 저항군의 1예(20%)보다 많았으나 통계학적 차이는 없었고(P = 0.15), 안정적 질환(stable disease)을 포함한 질환 조절률(disease control rate) 역시 민감군에서 89.5% (17예)로 저항군의 60% (3예)에 비해 높았으나 유의한 차이는 없었다(P = 0.17). 전이병소의 최대직경 감소군(size reduction) 역시 민감군에서 16예(84.2%)로 저항군의 3예(60.0%)에 비해 많았으나 통계적 차이는 없었다(P = 0.24). 그러나 CEA 감소(CEA reduction)는 민감군에서 14예(73.7%)로 저항군의 1예(20.0%)에 비해 유의하게 높았다(P = 0.03). 2주기와 3주기 반응평가에서 민감군과 저항군 간에 RECIST평가(P = 0.87), 질환 조절률(P = 0.28), 최대 직경 감소(P = 0.34), 그리고 CEA감소 역시 양 군 간 차이는없었다.
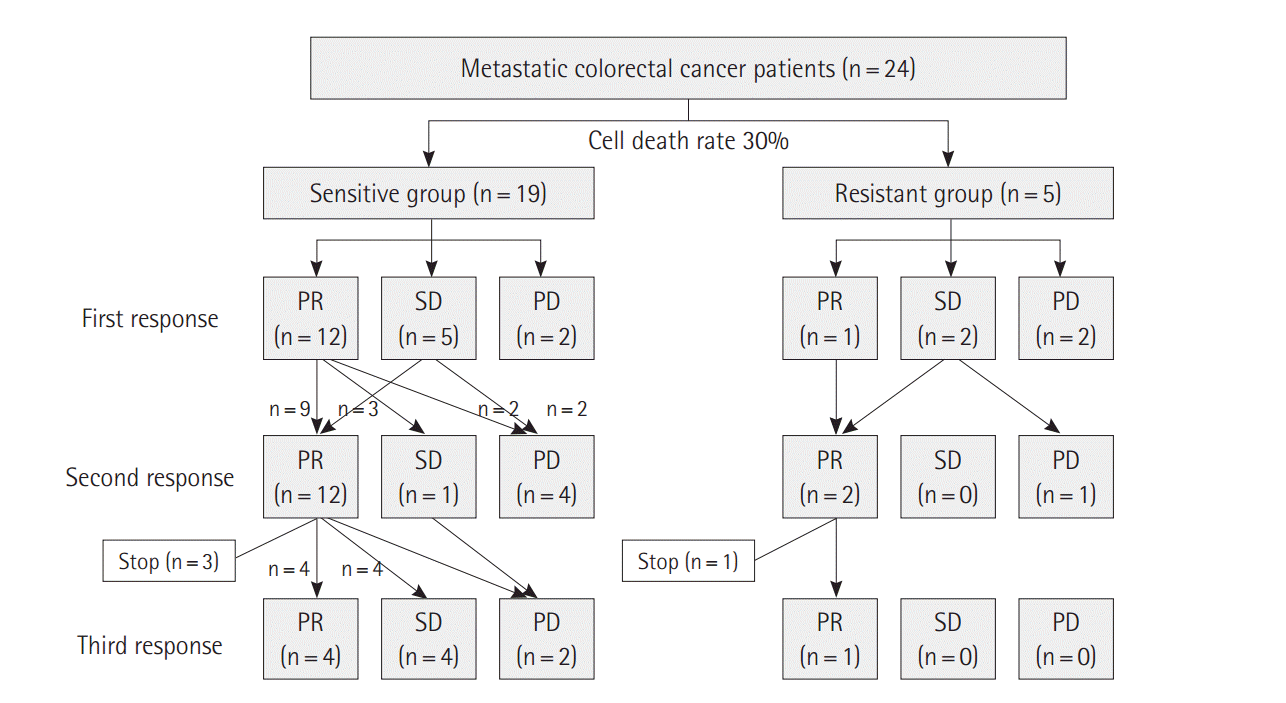
Patients flow sheet according to clinical response after chemotherapy. PR, partial response; SD, stable disease; PD, progressive disease.
1주기 반응평가에서 질환 조절률의 민감도, 특이도, 양성예측률 그리고 음성예측률은 각각 85.0%, 50.0%, 89.5%, 그리고 40.0%로 나타났다. CEA감소와 항암약물 감수성 결과에 대한 민감도는 93.3%와 음성예측률이 80.0%로 크기변화에 비해 높게 나타났다(Table 5). 그리고 2주기와 3기기 후 반응평가 결과에 따른 민감도 역시 1주기와 비슷하였다.
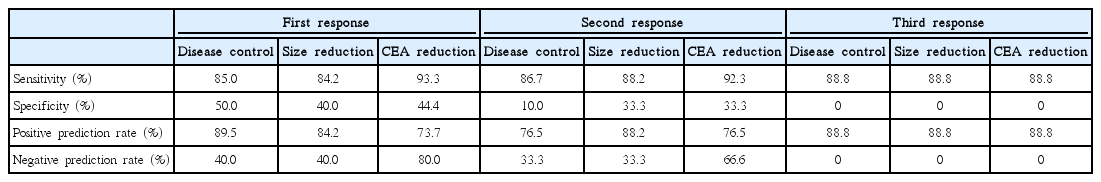
Sensitivity, specificity, positive prediction rate, and negative prediction rate by cell death rate 30%
완전관해를 보인 경우가 없어 부분반응을 기분으로 했을 때 1차 반응평가 후 부분반응군의 평균 세포사멸률은 52.6%로 안정적 혹은 진행성 질환군의 54.1%와 차이가 없었다(P = 0.837). 2차 평가 후에도 부분반응군과 안정적 혹은 진행성 질환군의 평균 세포사멸률은 54.4%와 54.0%로 차이가 없었다(P = 0.960). 3차 반응평가 후에는 부분반응군에서 평균 세포사멸률이 63.0%로 안정적 혹은 진행성 질환군의 49.0%에 비해 높았으나 통계학적 차이는 보이지 않았다(P = 0.192).
체외 항암약물 감수성에 따른 양군 간의 진행무병생존(Progression-free survival)
일차성 항암화학요법 후 전이성대장암의 진행무병생존 중위값은 민감군이 7.0개월(범위, 2–27개월)로 저항군이 5.0개월(범위, 3–12개월)에 길었으며 통계학적 차이는 없었으나 유의수준에 근접하였다(P = 0.056). 그러나 진행무병생존곡선에 통계학적 차이는 보이지 않았다(P = 0.165) (Fig. 2).

Progression-free survival (PFS) according to in vitro chemosensitivity result (cell death rate 30%) (P=0.165). Patients of sensitive group experienced amedian PFS of 7.0 months (range, 2–27 months), whereas those of resistant group experienced a median PFS of 5.0 months (range, 3–12 months) (P=0.056).
고 찰
전이성 대장암에서 항암화학요법은 환자생존을 연장시키기 위한 중요한 치료법이다. 항암화학요법의 종양 반응도는 환자마다 각기 다르지만 종양에 대한 항암약물의 다양한 반응을 미리 예측할 수 있다면 치료효과를 높일 수 있을 것이다[1,2,4]. ATP 이용 항암약물 감수성 검사는 대장암을 대상으로 몇몇 연구에서 감수성 검사와 치료반응간의 연관성에 대해 임상적 적용 가능성을 제한적으로 보고하였다[18,19,23]. 본 저자들은 전이성 대장암에서 일차성 항암화학요법과 항암약물 감수성 검사와의 임상적 반응을 비교하였다. 항암화학요법의 선택은 세포사멸률 30% 이상에서는 치료자의 선호도에 의해 결정되었으며 표적치료제는 사용되지 않았다. 저자들의 연구에서는 ATP 이용 항암약물 감수성 결과에서 항암약물 민감군에서 종양의 반응률이 높았으나 대상수의 제한으로 통계학적 유의성을 보여주지 못하였다. 그리고 3차례 반응평가 모두에서 약 85% 이상 높은 민감도를 보였으나, 특이도는 50% 미만으로 나타나 임상적 유용성에 대해 제한적으로 적용될 수 있음을 알 수 있었다[24].
지금까지 항암약물 감수성을 확인하기 위한 다양한 검사법이 시행되어 왔으나 배양시간, 성공률 그리고 임상적 반응과의 적합성 등의 문제로 아직 권고되는 검사법은 없는 실정이다[25]. ATP 이용 체외 항암감수성 검사법은 소량의 종양세포를 이용해 85% 이상의 높은 배양 성공률을 보이는 검사법으로 저자들의 결과도 유사하였다[13,20]. 세포에서 생성되는 ATP 수치에 대해 항암약물 처리 후 억제되는 정도를 종양세포사멸 기준으로 판단하는 검사법으로 폐암, 위암, 난소암 등의 다양한 암종에 대해 자주 연구되어왔다[14-16,20]. 몇몇 보고에 의하면 대장암에서도 ATP 이용 항암약물 감수성 검사는 타암종과 유사한 성공률을 보였으며 본 연구에서도 의뢰한 검사에 대한 성공률이 약 83%로 나타났으며 실패한 5예의 이유는 종양세포의 오염이거나 생존세포가 없었던 것으로 나타났다[13]. 각각의 항암약물에 대한 세포사멸률은 단일약제로 5-FU, irinotecan, 그리고 oxaliplatin은 평균 33.4%, 31.1%, 그리고 40.6%로 타연구 결과와 유사하였다[26]. 이에 비해 복합제제로 5-FU+irinotecan과 5-FU+oxaliplatin은 종양세포 평균 사멸률이 52.4%와 52.8%로 단일제제에 비해 높았다. 본 연구에서 단일 약제 사용군이 없어 임상적 반응도 비교가 되지 못했으나 대장암 항암화학요법의 임상연구 결과를 비교했을 때 단일제제에 비해 복합제제의 대장암에 대한 반응도가 높을 것이라 예상할 수 있을 것이다[24]. 또한 복합제제에 대한 항암약물 감수성 검사에 의한 높은 평균사멸률의 결과로 세포사멸률 30%를 기준으로 분류했을 때 연구대상 24예 중 19예(79.1%)가 일차성 항암화학요법제에 대한 민감군으로 실제 보고되는 임상적 반응률 최대 50%에 비해 항암약물 감수성 결과가 더 민감하게 나타났음을 알 수 있었다. 또한 항암약물 검사군의 17예(70.8%)는 두 가지 복합제제 모두에서 세포사멸률이 30% 이상으로 나타났으며, 5예(20.8%)만 두 가지 복합제제에 대한 민감성에 차이를 보여 임상적으로 항암약물 감수성 결과에 따른 약제 선택에 도움을 줄지에 대해서는 의문시된다.
대장암의 항암화학요법은 5-FU와 Leucovorin을 병합하는 요법이 근간을 이루고 있다. 전이성 대장암에서는 5-FU과 Leucovorin에 oxaliplatin 혹은 irinotecan을 병합해서 사용하는 복합요법이 표준항암화학요법으로 권고되고 있으며, 5-FU와 Leucovorin 대신 capecitabine을 이용해 oxaliplatin을 병합하는 방법이 동등한 치료법으로 사용될 수 있다[1,5,6]. 전이성 대장암에 대한 FOLFOX (or CapeOx)와 FOLFIRI 항암화학요법의 반응률은 31%–56%로 보고되지만 타 암종에 비해 다양한 약제 선택이 어려워 항암약물 감수성 검사에 의한 약제 선택 역시 제한을 받을 수 있다. 그러나 전이성 대장암에서 항암화학약제의 우수한 반응은 종양의 완전관해를 유도하기는 어려우나 종양의 크기를 적극 감소시킴으로써 전이성 병소에 대한 절제률을 높이고 환자 생존을 증가시킬 수 있다. 이러한 치료의 목적으로 최근에는 전이성 대장암에서 표적치료의 병합요법이 일반화되고 있다[2]. 그러므로 전이성 대장암에서 우수한 치료 반응은 환자의 생존을 증가시키는 데 더욱 도움을 줄 수 있다[2,4]. Hur 등[18]은 ATP 이용 항암감수성 결과에 의한 항암화학치료군에서 간절제율을 더 높일 수 있음을 보고하였고, Fan 등[19]도 더 높은 항암약물 민감도는 치료결과에 영향을 줄 수 있음을 보고하였다. 본 연구에서도 전이병소 절제는 민감군에서만 1주기에서 3주기 평가 후까지 5예에서 시행되었다. 이 중 2예는 각각 2곳의 최초 전이병소를, 나머지 3예는 4곳 이상의 다발성 병변이었다. 그러므로 항암약물 감수성에 민감할 경우 전이성 종양의 크기나 수의 감소를 예상할 수 있게 하였지만 부분반응 이상의 우수한 치료 반응을 보이는 군과 보이지 않는 군간에 세포사멸률의 뚜렷한 차이는 없어 항암약물에 대한 세포사멸률 정도에 따른 약제 선택이 필요할 지에 대해서는 아직 연구가 더 되어야 할 부분이다.
전이성 고형암종의 임상적 반응평가로 RECIST 평가법이 주로 이용되며 완전관해, 부분반응 그리고 안정적 질환을 질환 조절군으로 평가한다[21]. 본 연구에서는 일차성 항암화학요법제제에 대해 3차례 종양의 반응평가 후 각각의 반응평가 주기에서 민감군에서 질환 조절률이 약 76%–89%로 타 연구결과와 비슷하였으나 저항군과 비교해서는 유의한 차이를 보이지는 않았다[18]. 이러한 결과로 항암약물 감수성 검사의 민감도는 85%로 높지만 특이도와 음성예측도 약 50% 이하로 타 연구에 비해 낮음을 알 수 있었다[24]. 그리고 2주기 및 3주기 결과 후에도 임상적 반응과 유의한 차이가 없었다. 또한 체외 ATP이용 항암약물 감수성 검사의 약 70%에서 5-FU+oxaliplatin과 5-FU+irinotecan 병합 약물검사에 민감하게 나타났고, 2예는 모두 저항군으로 확인되었다. 이러한 점은 전이성대장암에서 사용 가능한 항암화학요법제제의 종류의 한계를 고려할 때 항암약물 감수성 검사가 임상적으로 유용하게 사용될 수 있을지에 대해서는 아직 의문의 여지가 있다. 그리고 크기측정에 비해 CEA 수치 증감으로 평가할 경우 1차 반응평가에서 민감군에서 혈액내 CEA 수치가 유의하게 감소비율이 높았고 항암약물 감수성과 CEA 반응 간의 민감도는 93.3%와 음성예측도가 80.0%로 가장 높아 항암화학요법에 대한 반응성 평가에 종양의 크기이외 CEA수치 변화도 고려하면 환자의 치료반응 예측에 더 도움을 줄 수 있을 것이다.
진행성 대장암에서 다양한 치료에 대한 평가로 종양의 반응률을 평가할 수도 있지만 진행무병기간 혹은 생존분석이 중요하다. 난소암 및 위암에 대한 연구에서 항암약물에 대한 민감군에서 저항군에 비해 질환의 진행무병기간에 차이가 있음이 보고되었으나 전이성 대장암에서 진행무병기간에 대한 보고는 매우 드물다[27,28]. 본 연구에 의하면 항암약물 감수성에 따른 진행무병기간의 차이는 민감군에서 중앙값이 7.0개월로 저항군의 5.0개월에 비해 높았으며 통계학적 차이는 보이지 않았지만 유의수준에 근접해 항암약물 민감도가 항암화학요법의 예후에 영향을 비칠 수 있음을 보여주었지만 대상환자수의 제한으로 진행무병생존곡선에 뚜렷한 차이는 보이지 못해 많은 수의 환자를 대상으로 결과분석이 필요할 것이다.
전이성 대장암에서 높은 반응성을 가진 항암화학요법의 시행은 환자의 생존율을 향상시킬 수 있는 기회를 제공한다. 본 연구에서는 전이성 대장암에 대한 일차성 항암화학요법 후 항암약물 민감군에서 임상적 반응이 더 우수하고 예후에도 영향을 미칠 수 있음을 예상할 수는 있었으나 대상수의 제한으로 통계학적으로는 유의한 결과를 얻을 수는 없었다. 또한 전이성 대장암 치료에 권고되는 항암화학요법을 고려할 때 항암약물 감수성 검사가 임상적으로 유용할지에 대해서는 좀 더 많은 환자수를 대상으로 하는 무작위 연구가 시행되어야 할 것이다.
Notes
No potential conflict of interest relevant to this article was reported.
Acknowledgements
This work was supported by a grant from Chunma Medical Research Foundation, Korea 2011.