재발한 대장암에서 재발 후 생존율에 영향을 미치는 위험인자 분석
The analysis of risk factors for overall survival after recurrence in recurred colorectal carcinoma
Article information
Trans Abstract
Purpose:
Recently, survival after recurrence (SAR) has been one of the major concerns after recurrence of colorectal carcinoma. To identify the risk factors about SAR is important as much as to identify the risk factors about recurrence. It provides us useful information for treatment strategy to know which patient will be expected with long term survival after recurrence. This study was aimed to identify the risk factors about overall SAR in recurred colorectal carcinoma.
Methods:
Between January 2002 and December 2005, two hundred twenty one patients, who had recurrence of colorectal carcinoma after initial curative resection at Seoul National University Hospital, were included. Clinicopathologic characteristics and survival outcomes were retrospectively reviewed. Survival analysis was performed to identify the risk factors for SAR.
Results:
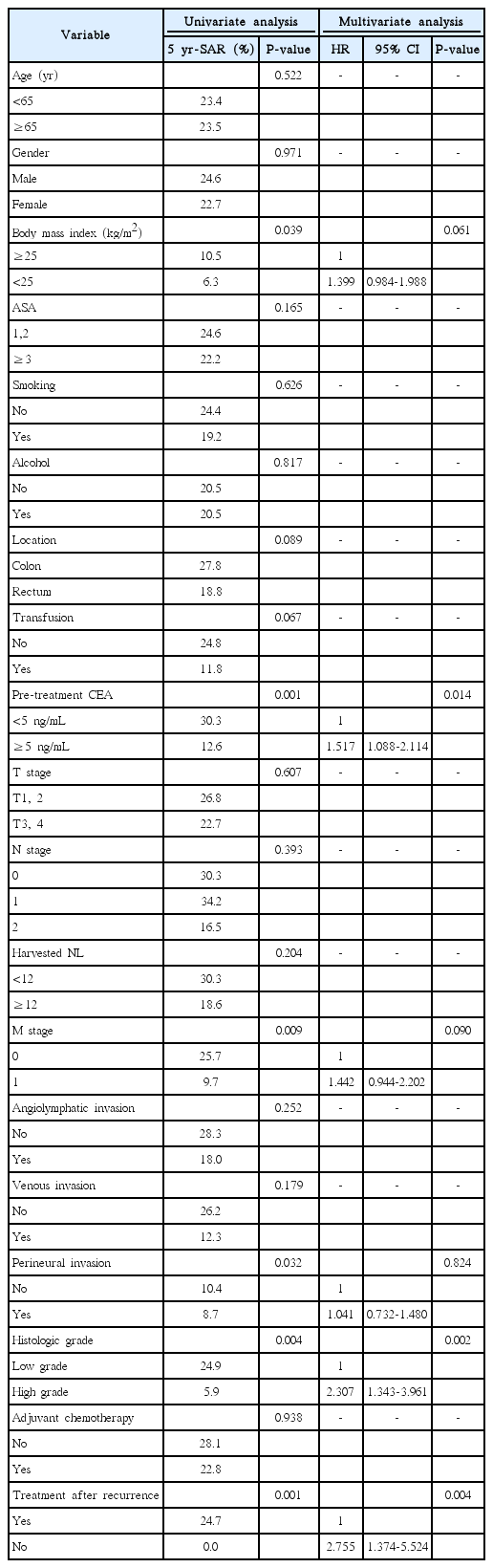
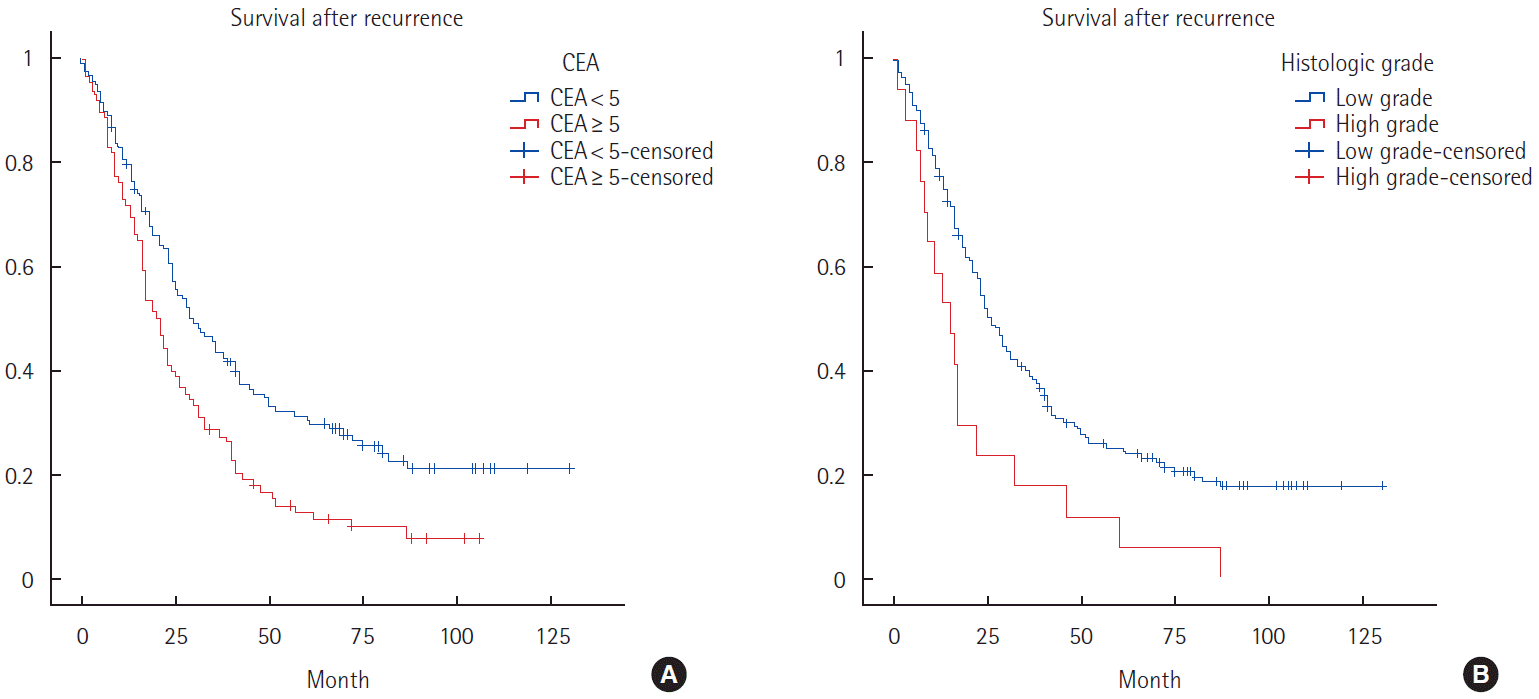
Median recurrence time after initial curative resection was 22.5 months (range, 0–93.0 month). Median follow-up time after recurrence was 34.8 months (range, 0–130.0 month). In univariate analysis, low body mass index, preoperative elevated carcinoembryonic antigen (CEA) level, high grade histology, metastatic disease and perineural invasion were significant associated with poor SAR. In multivariate analysis, preoperative elevated CEA (hazard ratio [HR], 1.517; 95% confidence interval [CI], 1.088–2.114; P=0.014), high grade histology (HR, 2.307; 95% CI, 1.343–3.961; P=0.002) and treatment after recurrence (HR, 2.755; 95% CI, 1.374–5.524; P=0.004) were significant associated with poor SAR.
Conclusion:
Preoperative elevated CEA, high grade histology and treatment after recurrence were independent risk factors for SAR.
서 론
대장암은 우리나라에서 갑상선암, 위암에 이어서 세 번째로 많이 발생하는 흔한 암으로 매년 약 3만 명의 환자가 발생하고, 폐암, 간암, 위암에 이어 네 번째로 사망률이 높다[1]. 전이가 없는 대장암 환자에서 수술만이 완치를 기대할 수 있는 치료법이며 보조요법은 재발의 위험을 줄일 수 있어서 2기 또는 3기의 환자에서 시행되고 있다[2]. 그러나 대장암 환자에서 적극적인 수술적 절제 및 추가적인 치료를 시행함에도 불구하고 근치적 절제를 시행 받은 환자의 30%–50%에서 대개 2년이내 재발을 경험한다[3-5]. 이전 연구들은 대부분 대장암 환자에서 재발 또는 생존에 영향을 미치는 예후 인자에 대한 연구를 시행하였다.
최근 들어 재발한 환자들에서 재발 이후 생존율(survival after recurrence, SAR)에 대한 관심이 높아지고 있으나, 현재까지 이에 관한 연구는 부족한 실정이다. SAR에 관련된 위험인자를 확인하는 것은 재발 이후 장기 생존율 예측을 가능하게 하여 치료방침에 중요한 정보를 제공할 수 있으므로 재발에 영향을 미치는 위험인자를 확인하는 것만큼 중요할 것으로 생각된다. 재발한 대장암 환자에서 재발 이후 생존율에 영향을 미치는 임상병리학적 인자들을 규명하는 것은 향후 재발한 환자들의 추적관찰 및 치료에 도움을 줄 수 있을 것으로 생각된다. 이 연구는 재발 이후 생존율에 연관된 위험요인들은 규명하기 위한 목적으로 시행하였다.
방 법
2002년 1월부터 2005년 12월까지 서울대학교병원 외과에서 원발 대장암으로 수술적 치료를 받은 환자 1,095명 중 재발을 경험한 환자 276명(25.2%)을 대상으로 하였다. 이들 중 유전성 대장암(가족성 샘종폴립증, 유전성비폴립결장암)으로 진단된 경우, 고식적 절제가 시행된 경우, 국소절제만 시행한 경우, 타 장기 원발성 암이 동반된 경우, 자료의 불충분 또는 추적 소실 등으로 분석이 불가한 경우들을 제외하였다. 이들 환자를 제외하고 최종 221명의 환자가 이 연구의 분석에 포함되었다.
원발암 수술 시행 당시 연령, 성별, 수술 일자, American Society of Anesthesiologists 점수, 체질량 지수, 흡연/음주의 사회력 여부, 종양의 위치, 수술 중 수혈여부, tumor node metastasis (TNM) 병기, 조직학적 등급, 수술 전 암태아성항원(carcinoembryonic antigen) 수치, 수술 후 보조항암화학요법의 유무, 재발기간, 재발 후 생존기간 등을 원내 전자의무기록을 통해 후향적으로 수집하였다.
생존율은 Kaplan-Meier 방법을 이용하여 산출하였다. 재발 후 생존율에 미치는 위험 인자에 대해 log-rank 방법으로 분석하였고, 다변량 분석은 Cox의 회귀 분석을 이용하였다. 통계 처리는 SPSS ver.21.0 (IBM Co., Somers, NY, USA) 프로그램을 이용하였고 통계적 유의성은 P<0.05를 기준으로 하였다.
결 과
환자들의 임상병리학적 특성은 Table 1에 나타내었다. 재발한 군의평균연령은 59.8세이고 65세 이상인 환자가 79명(35.7%)이었다. 남자의 비율은 64.3%이며, 체질량지수 25 미만인 환자가 전체의 70.6%였다. 수술 전 암태아성 항원의 값이 5 이상인 경우가 39.8%였고 조직학적 분류상 고등급인 경우가 7.7%였다. TNM 병기상 T3, 4 인 경우가 86.4%였고, N1, 2인 경우가 67.9%이며, M1인 경우가 31명(14.0%)였다. 기간 내 재발하지 않은 군과 비교하였을 때 재발한 군에서 직장암이 더 많이 분포하였고, 그로 인하여 전방 절제술이 더 많이 시행되었다. 또한 암태아성 항원이 증가된 경우가 유의하게 높았으며, 조직학적으로는 저등급인 경우가 많았으나 TNM 병기상 재발한 군이 보다 진행된 병기를 보였다. 림프관침범, 혈관침범, 신경주위침범, 수술 후 보조적 항암요법을 받은 경우가 통계적으로 유의하게 더 많이 존재하였다.
근치적 절제 이후 재발이 확인될 때까지 기간의 중앙값은 22.5개월(범위, 0–93.0개월)이었고 재발 후 추적 기간의 중앙값은 34.8개월(범위, 0–130.0개월)이었다. 재발 후 이에 대한 치료로 수술 없이 보조요법을 시행 받은 환자들은 147명(66.5%)으로 가장 많았다. 다음으로 보조요법 여부와 상관없이 수술을 시행 받은 환자들은 63명(28.5%)였고, 이 중 complete resection with no grossly visible tumor [R0] 절제를 받은 경우는 59명(93.7%)이었다. 마지막으로 치료를 받지 않은 환자들이 11명(5.0%)로 가장 적었다. 각 치료에 대한 생존분석에서는 수술을 시행 받은 환자들이 5년 생존율 50.2%로 가장 높았으며, 다음으로 수술 없이 보조요법을 시행 받은 환자들이 14.0%였고, 치료를 받지 않은 환자들은 5년안에 모두 사망하였다. 각 군의 생존율 차이는 통계적으로 유의 하였다(P<0.001).
재발 후 생존에 영향을 미치는 인자들에 대한 단변량 분석을 시행한 결과 낮은 체질량지수, 상승된 암태아성항원 수치와 높은 조직학적 분류도, M1 병기 및 신경침윤이 있는 경우, 재발 후 치료를 시행받지 않은 경우가 재발 이후 나쁜 예후와 연관되었다(Table 2). 다변량 분석을 시행한 결과에서는 수술 전 높은 암태아성항원(hazard ratio [HR], 1.591; 95% confidence interval [CI], 1.146–2.210; P=0.006), 높은 조직학도 정도(HR, 2.300; 95% CI, 1.342–3.942; P=0.002), 재발 후 치료를 시행 받지 않은 경우(HR, 2.755; 95% CI, 1.374–5.524; P=0.004)가 각각 재발 후 생존에 나쁜 영향을 미치는 독립 인자로 확인 되었다(Table 2, Fig. 1).
고 찰
본 연구에서는 대장암으로 진단 받아 근치적 수술을 시행한 후 재발한 환자에서 임상병리학적 인자들간 상관 관계 및 생존분석을 통해 재발 이후 생존에 영향을 미치는 세가지 인자를 밝혀냈다. 수술 전 검사상 상승된 암태아성항원 수치와 조직학적으로 고등급인 종양, 재발 후 치료를 받지 않은 경우가 재발 후 생존에 나쁜 영향을 미치는 위험 요인이다.
재발 후 생존율을 분석하기 위해서는 우선 재발에 영향을 주는 위험 요인에 대한 연구가 필요하며 그러한 요인들이 생존율과는 어떠한 상관관계가 있는지 밝혀내는 노력이 필요할 것이다. 이미 근치적 수술 후 재발과 관련된 위험 요인들을 밝혀내기 위한 여러 선행연구가 시행되어 왔고, 그러한 연구에서 보여주는 재발관련 위험인자들은 진단 시 연령, 성별, 암의 위치, 암태아성항원 수치, 조직학적 분화도 및 TNM 병기 등이다. Patel 등[6]은 최근 발표한 연구에서 stage I과 같은 초기 병기의 직장암에서 국소재발과 관련된 위험인자는 남자, 음주력, 종양의 궤양형 등이라고 보고하였고 65세 이상과 T2 병기가 생존율을 감소시킨다고 하였다. 또 다른 연구에서는 남자, 작은 크기의 종양, 낮은 암태아성항원 수치, 위치상 좌측결장 또는 직장에 발생한 암, polypoid형인 경우 그리고 분화도가 좋은 암이 5년 이후 후기에 재발하는 경향을 보인다고 보고하였다[7]. Lan 등[8]은 근치적 절제술 후 조기에 재발하는 군과 5년 이후에 재발하는 군을 나누어 재발 및 생존율에 영향을 미치는 인자에 대한 연구를 시행하였고 재발한 환자 중 59.7%가 2년내 사망하였고 그러한 환자들은 진단 시 나이가 많고, 분화도가 나쁘고 혈행 및 임파성 침범이 있는 경우가 많았다. 이는 생물학적으로 공격적인 특성을 가진 암이 조기 재발 및 조기 사망을 보이는 것으로 해석할 수 있겠다.
일반적으로 근치적 수술 후 재발까지의 기간은 재발 환자의 2/3 이상에서 2년 이내에 발생한다고 알려져 있다. Cho 등[7]의 연구에서도 65.8%의 환자가 2년 이내에 재발하였고, Chung 등[9] 또한 79%에서 2년이내 재발되었다고 보고하였으나, Moore 등[10]은 50% 환자에서 2년이내 재발하였고, 더 많은 수인 89% 환자에서 5년이내 재발한다고 보고하기도 하였다. 본 연구의 재발 기간 중간 값은 22.5개월(범위, 0–93개월)로 분석되었다.
재발하는 연령에 대해서는 연구마다 차이가 있었으나 낮은 연령에서 재발한다고 보고한 연구가 많았고[9,11], 본 연구에서는 진단시 연령이 재발 및 생존율에 유의한 차이를 보이지 않았다. 조직 분화도는 객관화가 힘들다는 문제점이 있으나[12] 분화도에 따라 재발률이 증가함을 확인하여 고등급의 악성 암일수록 재발률이 높다고 보고한 연구가 있으며[9], Kim 등[13]도 미분화 암의 경우 비교위험도 3.97로 유의한 예측인자임을 보고하였다. 임상적 병기는 결장직장암의 예후인자로 가장 중요하다고 생각되어왔으며 TNM병기에 따라 침습 정도와 림프절 침범여부, 원위부 전이 등으로 분류되는데 T병기에 따른 재발률의 비례적인 증가를 보인 연구들이 있었고[14], Merkel 등[15]의 연구 및 Chung 등[9]은 림프절 전이가 없는 경우 늦게 재발하는 경향을 보인다고 N병기와의 연관성을 보고하였다.
본 연구에서 단변량 분석을 통하여 유의성이 있다고 생각되는 인자들은 25 이하의 낮은 체질량지수(P=0.039) 수술 전 측정한 낮은 암태아성항원 수치(P=0.001), 조직학적으로 고등급(P=0.004), M1병기(P=0.009), 신경주위침윤(P=0.032) 등으로, 이는 지금까지 많은 선행연구에서 예후의 인자 또는 재발의 위험요인으로 다루어졌던 인자들과 유사하다. 또한 다변량 분석을 통해 수술 전 측정한 낮은 암태아성항원 수치(P=0.014), 조직학적으로 고등급(P=0.002)인종양, 재발 후 치료를 받지 않은 경우(P=0.004)가 결장직장암의 근치적 절제 후 재발 이후 생존에 관련된 유의한 독립인자로 확인할 수 있었다. 관련된 연구로 Tevis 등[16]의 연구 및 Mrak 등[17]도 수술 후 합병증이나 tumor의 extension 정도로 인해 보조요법을 받지 못하거나 치료가 늦어지는 경우 환자의 예후나 생존에 나쁜 영향을 준다고 하였다. 유사한 맥락으로 Cho 등[18]의 연구에서는 stage II 이상의 진행된 암에서 보조적 요법을 시행한 경우가 그렇지 않은 경우에 비해 생존율이나 향후 재발률에 대해 좋은 영향을 준다고 하였다.
본 연구를 통하여 결장직장암의 근치적 절제술 후 재발한 환자에서 생존율 및 이에 영향을 미치는 예측인자들을 규명할 수 있었으며 이를 바탕으로 수술 후 재발한 환자에서 고위험군에 대해 추적관찰 및 효과적인 관리에 도움이 될 것으로 생각된다. 재발 이후의 생존율과 관련된 인자들을 규명하는 데 대한 선행연구가 부족하다는 점에서 본 연구가 의미 있다고 할 수 있으나 단일 의료기관으로서 다른 의료기관과 비교대상이 없다는 점과 후향적 연구의 제한점을 고려할 때 향후 다 기관의 무작위 전향적 연구가 추가적으로 필요할 것으로 생각한다.
Notes
No potential conflict of interest relevant to this article was reported.