저위전방절제술에서 문합부 누출률을 줄이기 위한 피브린글루 사용의 효용성
Effect of using fibrin glue to reduce the rate of anastomotic leakage in low anterior resection
Article information
Trans Abstract
Purpose:
Anastomotic leakage (AL) is a major complication occurring after low anterior resection (LAR). Several methods for anastomotic protection have been tried. However, the effectiveness of these methods at preventing AL is questioned. The present study examined whether direct application of fibrin glue to an anastomotic site could be an effective method for reducing aspects of AL, such as leakage rate.
Methods:
This study targeted patients who had undergone LAR between March and September 2012 for primary rectal cancer or rectosigmoid cancer which curative resection was possible. Anastomosis was performed with end to end anastomosis in all patients. Fibrin glue was used in 99 patients and conventional methods in the controls (130 patients). The research was conducted as a prospective non-randomized study.
Results:
AL occurred in seven cases (7.1%) in the fibrin glue group and seven cases (5.4%) in the control group; this difference wasn’t statistically significant. No significant differences were found between the two groups in terms of clinical stage of primary cancer, operation time, and length of hospital stay after surgery or in the severity of leakage or the treatment policy decisions for patients with AL. An analysis of risk factors showed that the occurrence of AL was significantly higher in male patients.
Conclusion:
Fibrin glue applied to an anastomotic site to prevent AL during LAR did not reduce the rate of AL. No differences were noted in other aspects of AL that would favor the use of fibrin glue over conventional methods.
서 론
직장암의 가장 근본적인 치료는 근치적 절제술이다. 저위전방절제저위전방절제술을 시행할 경우 발생할 수 있는 여러 가지 합병증들 중 가장 치명적인 것은 문합부 누출로 이는 환자를 사망에까지 이르게 할 수 있다. 저위전방절제술에서 문합부 누출을 일으키는 원인으로는 수술 전 항암 방사선 치료로 인한 장의 부종, 섬유화, 부적절한 장의 혈류, 장내 압력 증가 등을 들 수 있다[1-4]. 수술 후 문합부 누출의 빈도는 3%–21%로 보고되고 있으며[5-7], 이는 외과의사가 가장 주의를 기울여야 하는 합병증이다. 따라서 이러한 문합부 누출을 낮추기 위해서 과거로부터 많은 노력이 있어 왔다. 이러한 노력들 중 하나로 일시적 장루 형성술이 있으나, 과연 이것이 문합부 누출률을 낮출 수 있는지에 대해서는 여전히 논란의 여지가 있다[8]. 또한 일시적 장루 형성술을 시행할 경우 복원수술을 다시 시행해야 하고, 이에 따른 합병증도 무시할 수 없다[9]. 따라서 복원수술과 이로 인한 합병증을 피하기 위해 직장 내 감압과 문합부 보호를 위한 경항문 스텐트나 튜브의 항문관내 삽입 등의 방법이 시도되고 있지만[10,11], 아직 검증된 방법은 없다.
본 연구는 문합부 누출을 막을 수 있는 방법의 하나로 문합 부위에 직접 피브린글루를 도포함으로써 문합부 누출의 빈도를 줄일 수 있는지 알기 위해 계획되었다. 문합부 누출 예방에서 피브린글루의 역할에 대해 몇몇 긍정적인 결과를 보인 연구가 있으나[12-14], 아직 이에 대해 충분한 임상적인 근거는 없으며, 최근 시행된 비슷한 연구에서 피브린글루 도포는 문합부 누출 보호 효과가 없는 것으로 밝혀졌다[14].
이에 본원에서는 저위전방절제술 시행 시 피브린글루를 문합부에 도포하는 것이 문합부 누출을 줄일 수 있는지, 그리고 피브린글루의 도포가 문합부 누출 양상에 영향을 주는지에 대하여 연구를 시행하였다.
방 법
2012년 3월부터 9월까지 근치적절제가 가능한 원발성 직장암 혹은 직장구불결장암으로 저위전방절제술을 시행받은 18세 이상의 환자를 대상으로 하였다. 이들은 개복수술 혹은 최소침습수술을 받았으며, 최소침습수술에는 고식적 복강경, 단일공 복강경, 수부보조 복강경, 로봇 수술이 모두 포함되었다. 모든 환자에서 문합은 단단 연결술로 시행되었다. 연구는 전향적 비무작위 연구로 진행되었고, 기관생명윤리위원회(Institutional Review Board) 승인 후 진행되었다(2012-02-020).
저위전방절제술을 시행받은 환자들 중에서 괄약근간 절제술이 시행되었거나, 병변의 위치가 항문에 가까워 손으로 직접 문합한 환자들은 제외되었다. 또한 동시성 대장암 등의 이유로 추가적인 장절제가 시행된 환자들과 다른 종류의 접착제가 도포된 환자들은 제외되었다.
총 278명의 환자들이 저위전방절제술을 받았으며, 이들 중 상기 기준에 따라 49명의 환자들이 제외되고 229명의 환자들이 참여되었다. 이 중 피브린글루가 도포된 환자들은 99명이었고, 대조군은 130명으로 선정되었다.
문합을 시행할 때 피브린글루 1 mL (CSL Behring, Marburg, Germany; 성분, human plasma fibrinogen 65–115; aprotinin 1000; human plasma thrombin 400–600; calcium chloride 13.9–15.6) 두 개를 사용하여 문합부의 전면과 후면 및 좌우 면에 적절히 도포하였다. 도포는 수술 부위의 세척 후 배액관 삽입 전에 이루어졌다.
이번 연구에서 문합부 누출은 임상적으로 발열, 백혈구 증가, 복통, 항문 통증, 혹은 배액관으로 대변이나 공기가 배출되는 등 문합부 누출을 시사하는 증상이 있으면서, 복부 컴퓨터단층촬영을 시행하였을 경우에는 영상검사에서 장벽의 결손이 확인되었거나, 대변의 복강 내 오염이 보이는 것으로 정의하였다.
문합부 누출의 위험인자에 대해 단변량분석을 시행하였으며, 위험인자는 다음과 같이 정의되었다. 60세를 고령의 기준으로 정하여 60세 미만과, 60세 이상의 환자로 나누었다. 신체비만지수(body mass index)는 연구에 참여한 모든 환자의 평균값인 23 kg/m2을 기준으로 23 kg/m2 미만인 군과 23 kg/m2 이상인 군으로 나누었으며, 같은 방법으로 문합부의 연결 부위는 5 cm를 기준으로, 수술 시간은 185분을 기준으로 하여 두 군으로 분류하였다. 수술 후 연식 섭취를 시작하게 되는 날을 2일 이전과 3일 이후로 분류하여 식이진행 시작일이 문합부 누출과 연관성이 있는지에 대하여 분석하였다. 수술 전 빈혈의 유무는 본원에서 사용하는 기준을 적용하여 여자는 11.2 g/dL 미만으로, 남자는 13.6 g/dL 미만으로 정의하였다.
또한 문합부 누출의 양상에 대해 누출된 곳의 방향, 누출에 의한 복막염의 정도, 환자의 증상 및 활력 징후와 패혈증 동반 여부를 분석하였다. 복막염은 국소적 복막염과 범발성 복막염으로 구분하였고, 이들은 영상의학검사 및 재수술 시 수술 소견을 바탕으로 분류되었다. 문합부 누출의 중증 정도는 다음과 같이 정의하였고[15], 이에 따른 치료방법을 비교하였다. A 등급은 문합부 누출이 있으나, 치료가 필요하지 않은 경우, B 등급은 문합부 누출에 대하여 수술을 제외한 적극적인 치료를 요하는 경우, C 등급은 문합부 누출에 대하여 수술이 필요한 경우로 분류하였다.
나이, 성별, 키, 몸무게, 신체비만지수, American Society of Anesthesiologists score 및 기저질환 등의 환자의 특성과 종양의 위치, 크기, 수술 전 치료 여부, 임상병기, 종양의 조직형, 최종병기 등과 같은 질환의 특성, 식이 진행 시작 시기와 재원 일수를 파악하였으며, 일차적으로 수술 후 문합부 누출의 유무를 분석하였다. 모수적 분석이 가능한 연속 변수에 대해서는 T-test를 사용하고, 불연속 변수에 대해서는 chi-square test를 사용하였다. 문합부 누출의 위험인자 분석을 위하여 로지스틱 회귀분석법을 이용하여 다변량 분석을 시행하였다. 단변량 분석에서 P<0.10인 인자들에 대하여 다변량 로지스틱 회귀분석을 시행하였으며, 결과의 해석 시 통계적 유의성은 P<0.05를 기준으로 하였다. 통계는 SPSS ver. 20.0 (IBM Co., Armonk, NY, USA)을 사용하였다.
결 과
환자 특성
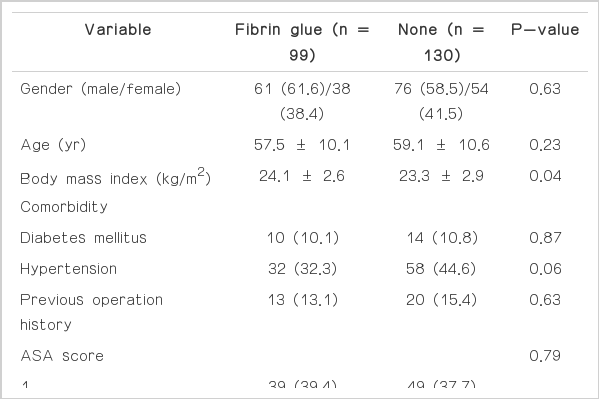
두 군에서 환자들의 성별, 연령, 기저질환 등에서의 차이는 보이지 않았다(Table 1). 원발암의 위치는 피브린글루군에서는 직장이 67명, 직장구불결장이 32명으로 나타났으며, 대조군은 각각 76명, 54명으로 차이는 없었다. 수술 방법은 두 군 모두 최소침습수술의 비율이 약 80% 정도로 나타났으며, 일시적 장루의 형성 비율은 각각 피브린글루군에서 27.3%와 대조군에서 30.8%로 나타났다. 대장 이외의 다른 장기 절제가 동반된 동시수술의 비율은 피브린글루군에서 4.0%, 대조군에서 7.7%로 나타났으나, 두 군 간에 통계학적 차이는 없었다. 수술 중 수혈의 빈도는 대조군에서 더 높았으나 통계학적인 의미는 없었다. 문합부는 두 군 모두 평균 항문연으로부터 약 5cm 상방에서 이루어 졌으며, 수술 시간은 각각 평균 184.8분, 185.0분으로 차이를 보이지 않았다. 수술 후 두 군에서의 식이 진행의 시기에는 유의한 차이가 없었으며, 수술 후 재원일수도 각각 9.08일, 8.52일로 비슷하였다. 각 군 환자의 American Joint Committee on Cancer stage에 따른 병기로 분류하였을 때, stage I은 피브린글루군은 32.3%, 대조군은 28.4%, stage II는 각각 24.2%, 22.3%, stage III는 각각 29.2%, 41.5%, stage IV는 각각 9.0%, 4.6%로 나타나, 두 군 간에 병기에 따른 통계학적 차이는 보이지 않았다. 원발 종양 크기의 평균은 각각 3.46 cm, 3.58 cm으로 나타났다. 이번 논문에서 확인하고자했던 문합부 누출의 비율은 피브린글루군에서는 7명(7.1%)으로 나타났고, 대조군에서도 7명(5.4%)으로 나타났다. 이들 간의 통계학적으로 유의한 차이는 보이지 않았다.
문합부 누출이 발생한 환자들의 임상적 특성
각 군에서의 누출의 양상을 비교하였다. 두 군 모두 7명의 환자에서 문합부 누출이 발생하였다(Table 2). 각 군은 앞서 언급하였던 누출의 중증도에 따라 분류되었으며 두 군 모두 1명만이 B군에 속하고 6명이 C군에 속하였다. 피브린글루군에서는 4명의 환자가 범발성 복막염을 보였으며 대조군에서는 3명의 환자에서 범발성 복막염의 소견이 나타났다. 미세천공의 빈도는 피브린글루군에서 2명, 대조군에서 4명으로 나타났으나 두 군 간에 유의한 차이를 보이지는 않았다. B군에 속하는 환자는 각 군당 1명으로 나타났으며 이들은 배액관 삽입, 항생제 치료 등의 보존적 치료를 받았다.
총 14명의 환자들 중 6명(42.9%)에게서 영상의학검사 및 육안으로 확인이 불가능한 미세천공이 나타났고, 육안적 천공이 발생한 나머지 8명의 환자들 중 5명(62.5%)에게서 문합부 후면 천공이 나타났다. 미세천공에 의한 문합부 누출이 발생한 환자 6명 중 4명이 국소적 복막염 소견을 보인 반면에, 육안적 천공이 발생한 8명의 환자들 중 국소적 복막염을 보인 환자는 3명뿐 이었다. 또한 문합부 후면에서 누출이 발생한 환자 5명에서는 1명을 제외하고는 모두 범발성 복막염의 소견을 보였다. 문합부 누출이 발생한 환자들의 수술 후 평균 재원 기간은 18.7일로 장기재원의 큰 원인으로 나타났다.
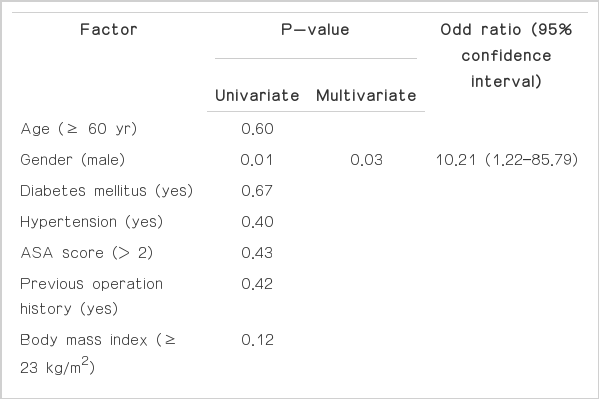
문합부 누출의 위험인자에 대한 단변량 분석의 결과는 다음과 같다(Table 3). 결과에서 통계학적으로 유의한 결과를 나타낸 인자로는 남성(P=0.01), 개복수술(P=0.03)이 의미 있는 결과를 나타냈다. P <0.1인 인자들로 다변량 분석을 시행하였을 때는 이 중 남성 (P=0.03)만이 문합부 누출의 위험인자로 나왔다.
고 찰
문합부 누출은 직장암 수술에서 발생할 수 있는 심각한 합병증이다. 저위전방절제술 후 발생하는 문합부 누출을 줄이기 위한 노력으로 일시적 장루 형성, 직장 내 감압을 위한 직장관 삽입, 문합부의 피브린글루 도포 등 많은 노력이 있어왔으나 명확하게 문합부 누출 예방 효과를 보이는 방법은 아직까지는 없는 실정이다.
과거 몇몇 동물 실험 연구에서 문합부의 피브린글루 도포가 문합부의 보호에 효과가 있다는 결과를 보였으나[13,16-18], 동물 실험에서는 주로 위공장문합, 하행결장 부분절제후문합, 우측결장절제술 등에 피브린글루를 사용하여, 본 연구에서 시행하였던 수술과는 차이가 있었다. 이러한 동물 실험 연구의 결과와는 반대로 Huh 등[14]은 저위전방절제술 후 문합부 누출 예방을 위한 피브린글루 도포가 문합부 누출을 예방하는 효과를 보이지 못한다고 보고하였으며, 문합부 누출은 장시간의 수술과 연관이 있다는 결론을 냈다. 본 연구와 다소 다르지만 Martin과 Au [19]는 유문부보존췌십이지장절제술 시행 후 췌장공장 문합부의 누출 예방을 위하여 마찬가지로 피브린글루를 도포를 시행하였으나, 누출률을 낮추지 못하였다고 보고하였다. Kanellos 등[13]은 시행한 연구에서는 장 내강 내 파열압력에 대하여 피브린글루를 도포한 군이 좀 더 높은 압력을 견디는 것으로 나타났지만, 이 또한 저위전방절제술 누출의 원인으로 생각되는 문합부위의 장력이나, 허혈성 손상과는 큰 연관성이 없는 것으로 보인다. 본 연구에서는 문합부에 도포되는 피브린글루는 문합부 누출을 줄이지 못했고 누출 양상에도 영향을 주지 못했다.
문합부 누출의 위험인자에 대해 시행된 여러 연구들에서는, 남성, 종양의 크기, 항문연에 가까운 문합부 위치, 수술 전 항암방사선치료 등이 위험인자로 밝혀졌다[1,20-24]. 본 연구에서는 이들 중 남성이 문합부 누출의 위험인자로 나타났다(Table 3). 남성의 골반은 여성에 비해 상대적으로 깊고 좁아 수술 시야 확보에 제한이 있다. 따라서 적절한 절제연을 따라 절제를 하는 것이 힘들고 수술 도중 조직의 손상을 더 많이 입을 수 있기 때문에 남성에서 문합부누출률이 높은 것으로 생각된다.
본 연구는 문합부 누출에 있어 피브린글루의 효과에 대해 현재까지 발표 된 논문 중에는 가장 많은 환자를 대상으로 하였으며, 유일한 전향적 연구라는 점에서 의의가 있다. 또한 본 연구는 문합부 누출의 양상에 대한 분석을 병행하였다는 점에서 다른 연구들과는 차이가 있다. 미세누출에 의한 국소적 복막염으로 확인된 환자들에서는 배액관 삽입, 항문관 삽입 및 항생제 치료 등 보존적 방법만으로도 치료가 될 수 있었다. 국소적 복막염의 여부는 발열, 복통, 백혈구 증가 등 임상적인 정보만으로는 구분을 하기 어려울 수 있으므로, 컴퓨터단층촬영을 시행하여 영상학적 정보와 함께 종합하여 접근하는 것이 좋을 것으로 생각된다.
저위전방절제술 시 문합부 누출을 예방하기 위하여 문합부에 도포되는 피브린글루는 문합부 누출을 줄이지 못하였으며, 피브린글루 사용여부에 따른 문합부 누출양상도 차이가 없었다.
Notes
No potential conflict of interest relevant to this article was reported.