유방암 환자에서 원발암과 재발암의 호르몬 수용체 변화
Change of the hormonal receptor expression in recurred breast cancer
Article information
Trans Abstract
Purpose:
Expression of hormone receptors in breast cancer is one of the most important factors in determining its therapeutic plan and prognosis. Various studies have been ongoing regarding resistance in anti-hormone and target therapy of primary and metastatic breast cancers, and hormonal receptor mutation has been pointed out as one of the possible reasons. The purpose of this study was to analyze hormonal receptor changes in primary and metastatic breast cancer patients and to investigate possible influential factors.
Methods:
Out of 1,620 breast cancer patients who were surgically treated from 1997 to 2013, 38 patients were selected whose tissue samples were adequate for detecting presence of hormonal receptor expression. The presence of estrogen receptor (ER), progesteron receptor (PR), human epidermal growth factor 2 (HER2) receptor mutations were retrospectively analyzed by immunohistochemical staining and fluorescence in-situ hybridization.
Results:
The positive rate of ER, PR, HER2 receptors were 50%, 47.3%, and 24.3% respectively. In comparison to primary breast cancer, the rate of receptor mutations in recurred and metastatic tissues were 23.6%, 26.3%, and 6.6%; the rate of changes in receptors from positive to negative and negative to positive showed no statistically significant difference.
Conclusion:
The expression of hormonal receptors in breast cancer tissue is considered as one of the significant factors in pathologic findings, and it is crucial in determining the course of treatment. Recently, performing a tissue biopsy of metastatic lesion in addition to surgically removing the primary cancer has been in trend. Since there are various treatment options for breast cancer including hormonal therapy, chemotherapy, surgery and target therapy, a biopsy of metastatic lesion should be carried out actively in order to increase the specificity of tissue pathology.
서 론
유방암은 한국 여성암 가운데 발생률 2위를 차지하는 암으로 1996년 약 4,000명의 환자에서 2010년 약 1만 6천명의 환자가 발생한 것으로 보고되었으며 점차 증가하는 추세이다(www.kbcs.or.kr, 한국유방암학회). 유방암의 치료방침 결정에 있어 원발 종양의 크기와 림프절 전이 및 호르몬 수용체의 발현여부가 중요한 역할을 하며 이 중 호르몬 수용체의 발현여부는 내분비 요법 및 표적 치료의 시행여부를 결정짓는 중요한 인자이다[1]. 또한 유방암세포 성질의 변화는 치료에 있어 반드시 고려해야 할 사항이며 호르몬 수용체 발현의 변화는 암세포 형질 변화의 대표적인 예이다[2]. 유방암 환자에서 전이 및 재발 조직의 수용체 발현 변화에 관한 연구는 최근 국내외에서 활발하게 이루어지고 있다. Amir 등[3], Amir과 Clemons [4]는 원발성 유방암 조직과 전이된 조직의 estrogen receptor (ER), progesteron receptor (PR), human epidermal growth factor 2 (HER2) 변화율을 각각 16%, 40%, 10%로 보고하였고, 이 변화에 의해 불필요하거나 부적절한 치료가 시행될 가능성에 대해 경고하였다. 따라서 임상적으로 잘 시행되지 않거나 어려운 전이부위의 조직 검사 및 수용체 검사를 가능한 시행할 것을 권장하였다.
또한 Regitnig 등[5]은 표적 치료의 여부를 결정 짓는 HER2의 다변성에 관하여 보고하였으며 원발성 종양에서 전이부로의 HER2 수용체변화를 31명 중 15명(48.4%)에서 나타났다고 하였으며 이 중 3예에서는 score 0에서 score 3로의 변화가 있었다. 또한 이 연구에 따르면 전이에 따른 질환의 말기 시에는 HER2 수용체의 과발현이 새롭게 나타나고, 혈장 내 HER2 수치가 증가한다고 보고 하였다. 본 연구에서는 재발성 유방암 환자에서 호르몬 수용체의 변화 양상을 알아보고 이에 영향을 미치는 요인을 알아보고자 하였다.
방 법
1997년부터 2013년까지 분당차병원에서 유방암으로 1,620명의 환자를 수술하였고 재발한 195명 중 국소 또는 원격 재발 후 재발 병변에 대한 수술이나 생검을 시행하여 조직을 얻을 수 있었던 38명의 환자를 대상으로 하였다. 원발암 및 재발암 조직에서 ER, PR, HER2의 면역조직화학염색를 시행하였고 수술 후 재발까지의 기간, 항호르몬 요법 및 항암화학요법 시행의 유무, 방사선 요법 시행 여부에 대하여 의무기록을 통해 후향적으로 조사하였다.
호르몬 수용체 면역조직화학염색의 판정은 염색의 강한 정도(0, 음성; 1, 약양성; 2, 중등도의 양성; 3, 강양성)와 양성으로 염색된 범위에 따른 점수를 통해 음성, 약양성, 중등도의 양성, 강양성으로 구분하였고, 본 연구에서는 중등도의 양성과 강양성을 양성으로 판정하였다. HER2 면역조직화학염색은 0 음성, 1+ 약양성, 2+ 중등도의 양성, 3+ 강양성으로 구분하였으며 면역조직화학염색상 3+ 또는 2+에서 형광제자리접합법(fluorescence in-situ hybridization)상 과발현이 되었을 때 양성으로 판정하였다.
원발성 유방암에서 폐경 여부와 재발하기 전까지의 기간 동안 항암화학요법, 방사선요법, 항호르몬요법 시행 여부가 호르몬 수용체의 변화에 어떤 영향을 미치는지에 대해 알아보고자 하였다. 통계학적 분석을 위해 SAS ver. 9.1 (SAS Inc., Cary, NC, USA)를 사용하였고, 원인 인자와 호르몬 수용체의 상관 관계를 알아보기 위해 Fisher exact test를 사용하였으며, P 값이 0.05 미만인 것을 통계적으로 유의한 것으로 판단하였다.
결 과
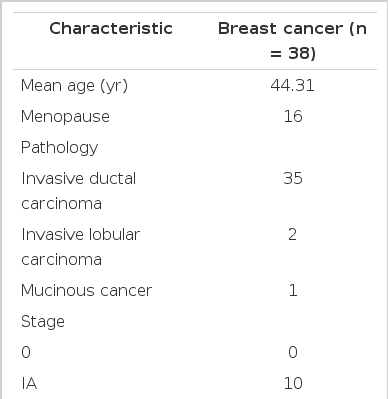
연구 대상자의 원발성 유방암 수술 당시의 평균 연령은 44.31세(범위, 31-65세)였으며 이 중 유방 보존술을 받은 환자가 12예, 근치적 유방 전 절제술을 받은 환자는 26예였다. 조직 검사 결과 침윤성 관암종이 35예, 침윤성 소엽암종이 2예, 점액암종이 1예 있었다. 수술 당시의 병기는 1기 10예, 2기 18예, 3기 10예가 있었고 수술 전 선행 항암화학요법을 받은 환자는 8예였으며 FAC (fluorouracil, doxorubicin, cyclophosphamide, 5예), AT (doxorubicin, docetaxel, 3예)를 시행하였고, 수술 후 36예에서 보조항암화학요법을 시행하였다. 재발까지의 평균 무병기간은 46.86개월(범위, 4-128개월)이었으며 재발 부위는 원발성 병변의 동측 흉벽 9예, 동측 액와부 7예, 동측 쇄골 상부 1예, 동측 유방 9예, 골 3예, 뇌 1예, 간 3예, 폐 5예로 관찰되었다(Table 1).
원발성 조직의 ER, PR, HER2 양성은 각각 19예(50%), 18예(47.3%), 9예(30%)에서 관찰되었고 재발성 조직의 ER , PR, HER2 양성은 각각 20예(52.6%), 19예(50%), 9예(30%)였다. 이중 원발성 조직과 재발 조직의 호르몬 수용체 변화는 각각 ER 23.6% (9예), PR 26.3%(10예), HER2 6.6% (2예)에서 나타났다. 호르몬 수용체의 삼중복 음성인 환자는 원발 조직 12예에서 나타났으며, 재발조직 6예에서 나타났다. 재발 조직의 ER 변화는 총 9예 중 양성에서 음성으로의 변화가 4예, 음성에서 양성으로의 변화는 5예에서 관찰되었고 PR의 변화는 총 10예 중 양성에서 음성으로의 변화가 5예, 음성에서 양성으로의 변화가 5예에서 관찰되었다. HER2의 변화는 총 2예 중 양성에서 음성으로의 변화가 1예, 음성에서 양성으로의 변화는 1예였다. 호르몬 수용체의 변화는 양성에서 음성으로의 변화율과 음성에서 양성으로의 변화율 간의 차이를 보이지는 않았다(Table 2).
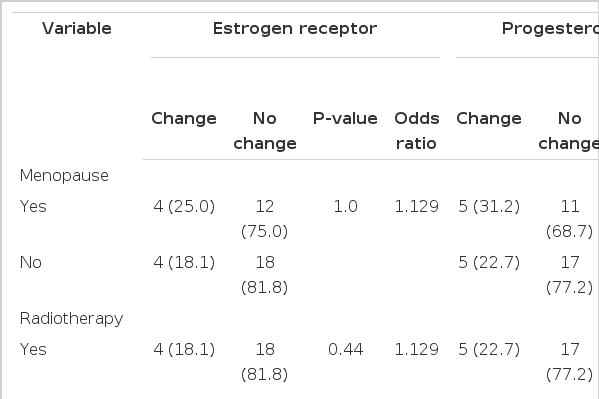
호르몬 수용체 변화에 영향을 미치는 요인을 분석한 결과 환자의 폐경 여부나 재발 전까지의 항암화학요법, 항호르몬 요법, 방사선 요법 여부의 상관 관계는 통계학적으로 유의하지 않았다(Table 3).
고 찰
유방암 환자의 호르몬 수용체 발현은 조직 검사에서 중요한 인자로 인식되고 있으며 환자 치료 방침에 결정적 영향을 미치고 있다. 원발성 유방암에서 전이된 유방암 조직의 호르몬 수용체 변화에 대해 수십 년 전부터 보고하고 있고[4], 최근에는 재발한 유방암에서 수술을 시행하여 조직을 얻는 경우 뿐 아니라 전이부의 조직 검사 또한 늘어나고 있다. 그러나, 전이부의 조직 검사는 적절한 검체를 얻기 어렵고, 조직 검사 후의 합병증 및 환자에게 고통을 준다는 점에서 어려움이 있다.
일반적으로 유방암에서 호르몬 수용체의 양성은 예후가 좋으며, 종양 수용체의 삼중복 음성(triple-negative)은 호르몬 치료 및 표적 치료의 기회를 얻지 못하고 있기 때문에 예후가 나쁘다[6]. 원발암의 호르몬 수용체 양성 여부 검사가 환자의 예후 및 치료 방향에 결정적인 영향을 미치고 있고 유방암의 전이 및 재발에서도 치료에 대한 결정적인 영향을 미친다[7]. 본 연구에서 비록 환자군은 작았지만, 유방암 호르몬 수용체의 변화는 원발암과 비교하여 전이 및 재발에서 ER 23.6% (9예), PR 26.3% (10예), HER2 6.6% (2예)로 의미 있는 변화율을 보였다. Choi 등[8]의 연구에서는 종양 수용체 변화의 양상이 양성에서 음성으로의 변화가 더 많다고 보고하였으며, 재발 및 전이암에서의 삼중복 음성이 증가함을 보고하였다. 하지만 본 연구에서는 양성에서 음성으로의 변화율과 음성에서 양성으로의 변화율에는 큰 차이를 보이지 않았고, 삼중복 음성은 오히려 감소하였다.
Um 등[9]은 유방암 조직에서 ER에 관한 이질성에 관한 연구를 진행하였고, 같은 암조직에서 ER의 변화율을 22.4%로 보고하였다. 이러한 변화 양상을 보이는 환자군의 성격은 50세 미만의 비교적 젊은 환자, 폐경 전, 이른 병기, ER의 낮은 positive율이라는 특성을 발견하였다[9]. 유방암 세포의 이질성은 ER+/sensitivity한 세포와 ER-/insensitivity한 세포가 섞여 있고 ER에 sensitive한 세포가 내분비 치료 중에 감소하고 결국 ER에 insensitive한 세포가 증식하게 되어 항호르몬 치료에 내성 발현을 설명하는 clonal selection 가설을 뒷받침하고 있다[10,11]. 유방암 세포의 이질성은 동시성과 이시성으로 발현될 수 있는데, 암 세포의 이질성은 조직 검사의 결과에 따라 치료 방향에 영향을 미치므로 그 중요성에 대하여 강조하였다[12].
Niikura 등[13]이 발표한 연구에서는 유방암에서 원발암과 전이암의 HER2 불일치를 보이는 경우를 24%로 보고하였다. 이 변화는 Trastuzumab의 사용보다는 항암약물치료를 시행한 환자군에서 HER2의 변화율이 높았고, HER2변화가 일어나는 환자 군에서의 전체적인 생존율은 좋지 않다고 보고하였다. 또한 이 연구에서 HER2의 면역조직 화학 염색과 형광제자리접합법의 결과가 12% 상이한 결과가 나와 면역조직화학염색과 형광제자리접합법을 동시에 시행할 것을 주장하였다[13]. 원발암 조직 검사 뿐 아니라 전이가 있는 모든 환자의 예에서 적절한 표적 치료 및 환자의 예후를 판단하기 위하여 조직에서 HER2의 면역조직화학검사 및 형광제자리접합법을 동시에 시행할 것을 권고하고 있다[14]. Pusztai 등[15]은 수용체의 불일치를 보이는 이유를 세가지 요인으로 정리하였다. 첫째, 질환의 생물학적 특성이 바뀌는 것, 둘째, 국소적인 수용체 양성조직에서의 검체 에러, 셋째, 수용체 재현성과 검사 정확성의 한계로 설명하였다. 따라서, 반복적인 암 조직의 생검은 임상적으로 위음성이나, 암 전이의 진단이 불확실할 때 이루어져야 한다고 하였다[15]. 본 연구에 있어서 비록 환자 대상군이 충분치 않아 수용체 변화와 원인에 대하여 확실한 상관관계를 찾지는 못하였지만, 수용체 변화 양상에 대하여 확인할 수 있었으며, 앞으로의 유방암 환자의 치료에 있어 재발암의 종양 수용체 검사의 필요성을 강조하는 계기가 될 것으로 생각된다.
본 연구에서 유방의 재발 및 전이암 조직의 수용체 변화율은 ER 23.6% (9예), PR 26.3% (10예), HER2 6.6% (2예)의 변화를 보였다. 본 연구를 통하여 유방암에서 원발암과 재발암의 수용체 변화는 상당수 있음을 알 수 있다. 따라서, 전이 유방암의 치료에 있어서 호르몬 수용체 검사를 통해 변화 양상의 확인이 필요할 것으로 생각된다.
Notes
No potential conflict of interest relevant to this article was reported.