절제 불가능한 전이가 동반된 4기 대장암 환자의 고식적 복강경 대장절제
ABSTRACT
Purpose:
This study aimed to evaluate role of palliative laparoscopic colorectal resection for patients with stage IV colorectal cancer with unresectable metastasis.
Methods:
We reviewed 248 patients with stage IV colorectal cancer who underwent palliative bowel resection of the primary tumor during the period from January 2008 to December 2010 at Asan Medical Center. The short-term and oncologic outcomes of those with laparoscopic resection were reviewed and comparison was made between patients with laparoscopic and open resection.
Results:
A total of 248 patients were identified and of these patients, 50 underwent laparoscopic resection and conversion was required in six patients (12.0%). There was no differences in the gender, age, the location of primary tumor. But in the open group, peritoneal seeding was more (31.8% vs. 14.3%) and lung metastasis was less (28.3% vs. 48.0%; P=0.023) than laparoscopic group. The length of postoperative hospital stay in the laparoscopic group was significantly shorter than that in the open group (10.4 days vs. 6.7 days; P=0.048), and the postoperative complications were no significant difference in the both groups (13.1% vs. 8.0%; P=0.466) The overall survivals were similar in the both groups (mean survival, 758 days vs. 851 days; P=0.278).
Conclusion:
Considering of the patient’s general condition and distant metastasis, laparoscopic palliative bowel resection for stage IV colorectal cancer with unresectable metastasis is effective and safe.
Keywords: Colorectal neoplasms, Laparoscopy, Palliative resection
서 론
외과 영역에서 복강경 수술은 개복수술과 비교하여 수술 후 통증 및 진통제의 사용이 적고, 장운동의 회복이 빠르며 재원 기간이 단축 되는 등 환자의 회복과 미용적인 장점이 있어 널리 사용되고 있다[ 1]. 최근에는 수술 도구의 발전과 기술의 축적으로 악성 질환에서의 복강경 수술도 많이 사용되고 있으며, 특히 결장암의 경우에는 대규모의 다기관 전향 비교 연구결과 복강경 수술이 개복수술과 비교하여 근치적 수술로서 안전하고 종양학적 결과에서도 차이를 보이지 않음이 확인되어[ 2, 3], 점차 그 적용 범위가 확대되고 있다. 치유가 불가능한 전이를 동반한 4기 대장암 환자를 치료할 때 출혈이나 장폐쇄 등의 증상이 있는 경우에는 원발 종양에 대한 고식적 절제가 권유되고 있으나[ 4, 5], 무증상의 4기암의 적절한 치료방법에 대해서는 논란이 있다. 또한 4기 대장암 환자의 원발성 병변을 절제할 때 복강경 수술이 단기 결과에 있어서 안전하고 효과적이라는 일부 보고가[ 6, 7] 있으나 기복형성에 의한 종양파급의 위험성을 포함한 장기 종양학적 성적 등에 있어서는 보고된 연구결과가 부족한 상태이다. 본 연구의 목적은 단일 기관에서 근치적 절제가 불가능한 전이를 동반한 4기 대장암 환자에서 원발 종양에 대한 고식적 절제를 시행할 때 개복술과 복강경 수술의 단기 결과 및 종양학적 장기 결과를 비교하여 이러한 환자군에서 복강경 수술의 역할을 알아보고자 하는 것이다.
방 법
2008년 1월부터 2010년 12월까지 총 4,219명의 환자가 서울아산병원 대장항문외과에서 원발성 대장암으로 수술을 시행받았다. 이 중에서 697명의 환자(16.5%)가 수술적 치료 시 전신전이가 동반된 4기 상태였으며 이 연구는 이들 중 원발병변에 대해 고식적 절제술만을 시행받은 248예(전체의 5.9%, 4기 대장암 환자의 35.6%)를 대상으로 하였다. 연구에 포함된 248예를 제외한 449명은 원발병변의 절제가 불가능하여 대장암에 의한 증상만을 완화하기 위해 단순장루조성술 혹은 장관-우회술만을 시행한 환자가 109예, 전이병변에 대하여 국소적인 완전치료를 위해 절제 혹은 고주파열치료를 함께 시행한 환자가 340예였다. 따라서 이 연구대상의 기준은 수술적 치료를 시행할 당시 전신전이가 동반된 상태에서 전신전이의 국소적 치료는 임상적으로 무의미하다고 판단되었거나 기술적으로 불가능한 상태에서 원발병소의 수술적 절제가 가능하였던 환자군으로 정의하였다. 원발병소와 전이성 병변에 대한 수술적 절제의 가능성 및 치료방법은 종양외과의, 종양내과의, 방사선과의사가 포함된 다학제적 진료를 통하여 결정하였으며, 이러한 다학제 진료가 시기적으로 불가능하였던 응급환자의 경우에는 환자의 수술을 담당하였던 종양외과의의 단독적인 결정으로 치료방법이 결정되었다. 환자들의 수술은 원발병변의 완전 절제 및 장관문합, 배액림프절의 최대한의 제거를 목표로 하였다. 연구에 포함된 모든 환자들의 자료는 전향적으로 수집되는 데이터베이스에서 추출하였으며 이를 후향적으로 분석하였다. 응급수술과 정규수술을 모두 포함하였고, 시행한 수술에 따라 개복군과 복강경군 두 군으로 분류하였다. 두 군 간의 임상병리학적 특성과 수술 후 단기성적의 비교는 chi-square법을 이용하였고, 생존율 비교는 Kaplan-Meier법을 이용하였다. P값이 0.05 이하일 때 통계적인 의의가 있는 것으로 간주하였다.
결 과
전체 248예 중에서 남자는 133명(53.6%), 여자는 115명(46.4%)이었으며, 평균 연령은 60.4세였다. 개복군은 198예(79.8%), 복강경군은 50예(20.2%)였으며, 복강경군에서 개복술로 전환된 경우는 6예(12.0%)였다. 전환의 이유는 종양이 타 장기를 침범하였던 경우가 4예, 종양이 천공되어 농양을 형성한 경우가 1예, 장폐쇄로 인해 소장의 심한 확장이 1예였다. 두 군 간의 임상병리학적 특징을 Table 1에 정리하여 비교하였다. 두 군 간 성별, 연령, 종양의 위치는 차이가 없었으나, 절제 불가능한 전이의 위치는 개복군이 복강경군에 비하여 복막전이가 많고(31.8% vs. 14.3%), 폐전이가 적었다(28.3% vs. 48.0%). 두 군 간의 수술 후 단기결과는 Table 2에 비교하였다. 복강경군의 수술 후 단기결과에는 개복으로 전환한 6명의 자료는 제외하였다. 시행된 수술 및 수술 후 합병증, 항암제 치료까지의 시간 등은 두 군 간에 차이 없었다. 수술 후 재원일수는 개복군에서 10.4일, 복강경군에서 6.7일로 유의한 차이가 있었으며(P= 0.048), 수술 후 사망은 개복군에서 3명(1.5%) 발생하였으나 복강경군에서는 발생하지 않았다. 개복군에서 수술 후 사망은 종양의 천공으로 인한 복막염이 동반된 패혈성 쇼크 1예, 허혈성 장염으로 인한 다장기부전 1예, 간경화가 있던 환자가 간부전이 진행되어 사망한 경우가 1예였다. 수술 후 시행한 항암 치료는 Table 3에 비교하였으며, 항암 치료간의 유의한 차이를 보이지 않았다. 추적 관찰기간의 중앙값은 41.4개월이었고, 관찰기간 동안 개복군의 153명(77.3%), 복강경군의 30명(68.2%)이 사망하였으며, 두 군 간의 평균 생존기간은 유의한 차이를 보이지 않았다(개복군 758일 vs. 복강경군 851일; P= 0.278) ( Table 4, Fig. 1).
고 찰
대장암 환자들의 약 20%은 진단 당시 전이가 동반되며, 이들의 5년 생존율은 12.5% 정도이다[ 8, 9]. 항암단독치료를 받은 경우에 5년 생존율은 10% 이하였지만, 최근 항암치료의 성적이 발전하면서 평균 생존기간이 20개월로 보고되고 있다[ 10]. 일반적으로 4기 대장암 환자에서 출혈이나 장폐쇄, 천공 등의 증상이 있는 경우에는 원발 종양에 대한 고식적 절제가 필요하지만, 증상이 없는 4기 환자의 경우 에 원발부위의 고식적 절제에 대해서는 아직 논란이 있다. National Comprehensive Cancer Network (NCCN)의 진료지침에 따르면 증상이 없는 치유 불가능한 4기 대장암 환자에게는 수술적 치료를 하지않고 항암단독치료를 하는 것이 권고되고 있으며[ 11], 고식적 절제로 인해 합병증 및 사망률이 증가하거나 이로 인해 항암치료의 적용시기가 미루어질 수 있다는 보고도 있다[ 12]. Poultsides 등[ 13]은 233명의 환자들을 대상으로 수술적 치료 없이 항암단독치료를 시행하였으며, 이 중 26명(11%)만이 원발종양에 대한 응급수술이 필요하였고, 10명(4%)이 증상해결을 위한 시술이 필요하였다고 보고함으로써 예방적인 고식적 절제 없이 항암단독치료가 가능하다는 의견을 제시하였다. 또한 Cirocchi 등[ 14]도 무증상의 4기 대장암 환자에 있어 원발종양을 절제하는 것은 생존율의 향상에 도움이 되지 않으며, 원발 종양에 따른 합병증을 감소시키는 데 유의한 차이를 보이지 않는다고 보고하였다. 하지만, 이와는 다르게 원발부위를 고식적 절제하는 것이 원발암의 진행으로 인한 응급 수술 혹은 시술을 줄일 수 있으며[ 4, 5], 또한 고식적 절제 후 항암치료를 적용하는 것이 항암 단독치료보다 생존율을 높일 수 있다는 보고도 있다[ 15]. Cook 등[ 9]은 17,658명의 환자를 대상으로 진행한 대규모 연구에서 60% 이상의 환자들에서 원발종양의 고식적 절제가 시행되었고, 고식적 절제를 한 군이 절제를 하지 않은 군보다 중앙생존기간 및 1년 생존율이 더 높다고 보고하였다(중앙생존기간 11개월 vs. 2개월; 1년 생존율 45% vs. 12%; P< 0.001). 또한 최근 8개의 후향적 연구들을 메타 분석한 Stillwell 등[ 4]에 따르면 증상이 없거나 증상이 미약한 4기 대장암 환자들에서 원발 종양을 고식적 절제하는 것은 원발 종양에 따른 합병증의 감소와 응급 시술의 필요성을 감소시키고, 6개월 가량 생존율을 증가시킨다고 보고함으로써(SD, 0.55; 95% confidence interval, 0.29-0.82; P< 0.001) 증상의 여부에 상관없이 고식적 절제의 임상적 효용성이 있음을 증명하였다. 본 연구에서는 증상의 유무에 따라 환자들의 치료를 결정하지는 않았다. 그러나 4기 대장암 환자들의 경우 종양의 크기와 진행으로 인하여 어떤 형태로든 증상이 있는 경우가 대부분으로, 완전 무증상의 4기 환자는 매우 드문 것이 일반적이다. 또한 현재 무증상이라 하더라도, 경과 관찰 혹은 치료과정 중에 원발병변으로 인한 장폐쇄가 발생할 가능성이 있고, 식이 진행이 어려워지거나 종양의 출혈로 인한 빈혈 등 전신상태가 불량하여 향후 치료에 지장이 발생할 가능성이 높기 때문에 환자의 전신상태가 수술적 치료의 절대적인 금기가 아닌 경우라면 상당수에서 원발종양절제를 고려하는 것이 바람직하다. 최근 수술기법 및 수술 후 관리의 발달도 이러한 적극적인 치료의 도입을 가능하게 하고 있다.
치유가 가능한 대장암 환자에게 복강경 수술을 적용하는 것은 개복술과 비교하여 안전하고 종양학적 결과에 차이가 없다는 것이 대규모 무작위 임상연구들에 의해 보고되었으나[ 16, 17], 전이가 있는 4기 환자들에게 고식적 치료 목적으로 복강경을 적용하는 것에 대해서는 일부 논란이 있다. 이는 복강경 수술을 위해 기복을 하는 것이 오히려 복강내 종양의 파급을 야기할 가능성이 있기 때문이다. 하지만 현재까지 보고된 대부분의 연구에 의하면 4기 대장암 환자의 원발 종양을 절제할 때에도 복강경수술은 비교적 안전하고, 단기수술성적의 면에서도 1-3기 대장암의 경우와 마찬가지로 장점이 있음이 보고되고 있다[ 6, 7]. 복강경 수술을 시행하는 경우 수술시간은 길지만 출혈량이 적고, 재원기간 및 장운동 회복기간이 짧았으며, 수술 후 항암치료를 시작하기까지 걸린 시간이 짧고 생존율에 있어서는 유의한 차이를 보이지 않는 것이 보고되었다[ 18- 21]. 본 연구의 경우도 복강경으로 고식적 절제를 시행한 경우가 개복술을 적용한 경우에 비해 재원기간이 단축되는 효과를 보였으며, 생존율에서는 유의한 차이를 보이지 않았다. 본 연구에서 복강경 수술을 시도하였다가 개복술로 전환된 경우는 12%로 이는 이전의 연구들과 비교하였을 때 유사한 성적이다. Allaix 등[ 22]에 따르면 복강경에서 개복술로의 전환율은 지름이 5cm 이상으로 종양의 크기가 큰 경우 증가한다고 보고하였으나, 본 연구에서는 종양의 크기보다는 종양으로 인한 이차적인 변화(종양의 타 장기침습, 천공, 장폐쇄로 인한 소장확장)가 전환의 원인으로 분석되었다. Fukunaga 등[ 23]의 연구에서도 0-3기 환자와 4기 환자를 비교하였을 때, 종양의 크기에서 차이가 있음에도 불구하고 개복전환율은 차이 없음을 보고하였다. Gonzalez 등[ 24]은 출혈이나 천공, 폐색 증상으로 인해 응급 복강경 수술에 들어간 환자들을 대상으로 연구를 진행하였는데, 이 중 86%의 환자가 대장절제술을 시행하였음에도 불구하고 개복 전환율은 14%였다. 또한 Scheidbach 등[ 25]에 따르면 양성 질환을 대상으로 한 경우나 고식적 절제를 하기 위한 경우 모두 개복 전환율에 유의한 차이를 보이지 않았다. 4기 대장암 환자들을 대상으로 진행한 Law 등[ 26]에 따르면 개복술로 전환된 경우 복강경으로 수술을 마친 경우와 비교하여 출혈량이 유의하게 더 많았으며(400 mL vs. 100 mL; P< 0.001), 통계적으로 유의하지는 않았으나 합병증 발생률이 높았다(30% vs. 9%; P= 0.149). 본 연구에서 개복으로 전환한 경우는 6예로, 증례의 수가 적어 이들의 성적을 비교하는 것은 의미가 적을 것으로 판단된다. 본 연구는 후향적 연구로 수술 방법의 선택은 집도의의 판단에 의존하였고, 이로 인해 선택편향의 문제점을 피할 수 없다. 특히 절제불가능한 전이의 위치에 있어서 개복군이 복강경군에 비하여 복막전이가 많고(31.8% vs. 14.3%), 폐전이가 적은(28.3% vs. 48.0%) 차이가 관찰되었다. 일반적으로 복막전이가 있는 경우 복강 내 암성 변화로 인하여 복강경 수술을 적용하기 어렵고, 수술 후에도 회복이 지연되며 항암치료에도 반응률에 차이가 있을 가능성이 있고, 이러한 차이가 장기성적에 영향을 줄 수 있다. 이러한 문제를 피하기 위해서 가장 이상적인 방법은 무작위 연구를 시행하는 것이지만, 이는 윤리적인 문제로 인해 실제 임상에서 적용하기에는 한계가 있다. 수술적 접근의 방법은 개별 환자의 종양학적 상태, 환자들의 전신상태, 집도의의 숙련도 등을 다각적으로 고려하여 결정하는 것이 타당하기 때문이다.
결론적으로, 절제불가능한 전신전이가 동반된 4기 대장암 환자에서 원발암에 대한 고식적인 절제만을 시행할 때 환자의 상태와 전이병변의 특성을 고려하여 적응이 되는 경우에 복강경수술을 적용하는 것은 개복수술과 비교하여 종양학적인 결과의 저하나 합병증 발생률의 증가 없이 최소침습수술의 장점을 얻을 수 있는 방법이다.
CONFLICT OF INTEREST
No potential conflict of interest relevant to this article was reported.
REFERENCES
1. Clinical Outcomes of Surgical Therapy Study Group. a comparison of laparoscopically assisted and open colectomy for colon cancer. N Engl J Med 2004;350:2050-9.
2. Bonjer HJ, Hop WC, Nelson H, Sargent DJ, Lacy AM, Castells A, et al. Laparoscopically assisted vs open colectomy for colon cancer: a meta-analysis. Arch Surg 2007;142:298-303.   3. Schwenk W, Haase O, Neudecker J, Muller JM. Short term benefits for laparoscopic colorectal resection. Cochrane Database Syst Rev 2005;(3):CD003145.   4. Stillwell AP, Buettner PG, Ho YH. Meta-analysis of survival of patients with stage IV colorectal cancer managed with surgical resection versus chemotherapy alone. World J Surg 2010;34:797-807.   5. Cummins ER, Vick KD, Poole GV. Incurable colorectal carcinoma: the role of surgical palliation. Am Surg 2004;70:433-7.  6. Verheijen PM, Stevenson AR, Lumley JW, Clark AJ, Stitz RW, Clark DA. Laparoscopic resection of advanced colorectal cancer. Br J Surg 2011;98:427-30.   7. Moloo H, Bedard EL, Poulin EC, Mamazza J, Gregoire R, Schlachta CM. Palliative laparoscopic resections for Stage IV colorectal cancer. Dis Colon Rectum 2006;49:213-8.   8. National Cancer Institute. SEER cancer statistics review 1975-2003. Bethesda: US Department of Health and Human Services; 2007 [cited 2013 Sep 25]. Available from: http://seer.cancer.gov/csr/1975_2003/. 9. Cook AD, Single R, McCahill LE. Surgical resection of primary tumors in patients who present with stage IV colorectal cancer: an analysis of surveillance, epidemiology, and end results data, 1988 to 2000. Ann Surg Oncol 2005;12:637-45.   11. National Comprehensive Cancer Network. . NCCN clinical practice guidelines in oncology 2013. Fort Washington, PA: National Comprehensive Cancer Network; 2013.
14. Cirocchi R, Trastulli S, Abraha I, Vettoretto N, Boselli C, Montedori A, et al. Non-resection versus resection for an asymptomatic primary tumour in patients with unresectable stage IV colorectal cancer. Cochrane Database Syst Rev 2012;8:CD008997.   17. Lacy AM, Garcia-Valdecasas JC, Delgado S, Castells A, Taura P, Pique JM, et al. Laparoscopy-assisted colectomy versus open colectomy for treatment of non-metastatic colon cancer: a randomised trial. Lancet 2002;359:2224-9.   18. Nishigori H, Ito M, Nishizawa Y, Kohyama A, Koda T, Nakajima K, et al. Laparoscopic surgery for palliative resection of the primary tumor in incurable stage IV colorectal cancer. Surg Endosc 2012;26:3201-6.   19. Hida K, Hasegawa S, Kinjo Y, Yoshimura K, Inomata M, Ito M, et al. Open versus laparoscopic resection of primary tumor for incurable stage IV colorectal cancer: a large multicenter consecutive patients cohort study. Ann Surg 2012;255:929-34.   20. Akagi T, Inomata M, Kitano S, Hida K, Sakai Y, Hasegawa S, et al. Multicenter study of short- and long-term outcomes of laparoscopic palliative resection for incurable, symptomatic stage IV colorectal cancer in Japan. J Gastrointest Surg 2013;17:776-83.   21. Akagi T, Inomata M, Etoh T, Yasuda K, Shiraishi N, Kitano S. Laparoscopic versus conventional palliative resection for incurable, symptomatic stage IV colorectal cancer: impact on short-term results. Surg Laparosc Endosc Percutan Tech 2011;21:184-7.   22. Allaix ME, Degiuli M, Giraudo G, Marano A, Morino M. Laparoscopic versus open colorectal resections in patients with symptomatic stage IV colorectal cancer. Surg Endosc 2012;26:2609-16.   23. Fukunaga Y, Higashino M, Tanimura S, Takemura M, Fujiwara Y, Osugi H. Laparoscopic surgery for stage IV colorectal cancer. Surg Endosc 2010;24:1353-9.   24. Gonzalez R, Smith CD, Ritter EM, Mason E, Duncan T, Ramshaw BJ. Laparoscopic palliative surgery for complicated colorectal cancer. Surg Endosc 2005;19:43-6.   25. Scheidbach H, Schubert D, Hugel O, van den Hoogen A, Rose J, Pross M, et al. Results of laparoscopic surgery for colorectal cancer in palliative intent: short-term end points in 331 patients in comparison with procedures in benign indications. Surg Laparosc Endosc Percutan Tech 2007;17:79-82.   26. Law WL, Fan JK, Poon JT, Choi H, Lo OS. Laparoscopic bowel resection in the setting of metastatic colorectal cancer. Ann Surg Oncol 2008;15:1424-8.  
Fig. 1.
Kaplan-Meier estimates of overall survival in the laparoscopic group and open group. 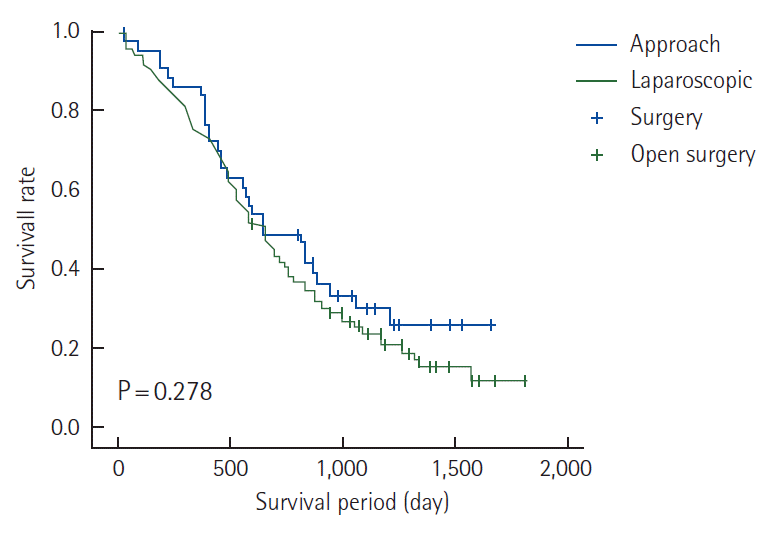
Table 1.
|
Variable |
Open surgery (n=198) |
Laparoscopic surgery (n=50) |
P-value |
|
Age (yr), median (range) |
60 (19-87) |
62 (34-83) |
0.477 |
|
Sex |
|
|
0.488 |
|
Male |
104 (52.5) |
29 (58.0) |
|
|
Female |
94 (47.5) |
21(42.0) |
|
|
Tumor location |
|
|
0.673 |
|
Cecum |
16 (8.1) |
2 (4.0) |
|
|
Ascending colon |
25 (12.6) |
10 (20.0) |
|
|
Hepatic flexure |
15 (7.6) |
6 (12.0) |
|
|
Transverse colon |
9 (4.5) |
1 (2.0) |
|
|
Splenic flexure |
4 (2.0) |
0 |
|
|
Descending colon |
4 (2.0) |
1 (2.0) |
|
|
Sigmoid colon |
60 (30.3) |
18 (36.0) |
|
|
Rectosigmoid junction |
24 (12.1) |
5 (10.0) |
|
|
Rectum |
40 (20.2) |
7 (14.0) |
|
|
Anus |
1 (0.5) |
0 |
|
|
Metastasis |
|
|
0.023 |
|
Lung |
56 (28.3) |
24 (48.0) |
|
|
Bone |
6 (3.0) |
1 (2.0) |
|
|
Liver |
140 (70.7) |
37 (74.0) |
|
|
Peritoneum |
61 (31.8) |
7 (14.3) |
|
|
Others |
44 (22.2) |
6 (12.0) |
|
|
TNM staging |
|
|
|
|
T |
|
|
0.319 |
|
T2 |
4 (2.1) |
2 (4.0) |
|
|
T3 |
135 (68.2) |
36 (72.0) |
|
|
T4 |
59 (29.8) |
12 (24.0) |
|
|
N |
|
|
0.764 |
|
N0 |
44 (22.2) |
11 (22.0) |
|
|
N1 |
69 (34.8) |
17 (34.0) |
|
|
N2 |
84 (42.4) |
22 (44.0) |
|
|
NX |
1 (0.5) |
2 (4.0) |
|
|
Differentiation Well |
8 (4.0) |
0 (0.0) |
0.128 |
|
Modreate |
148 (74.7) |
47 (94.0) |
|
|
Poor |
22 (11.1) |
1 (2.0) |
|
|
Mucinous |
16 (8.1) |
1 (2.0) |
|
|
Signet ring cell |
4 (2.0) |
1 (2.0) |
|
|
Perineural invasion |
|
|
0.277 |
|
(+) |
119 (60.1) |
27 (54.0) |
|
|
(-) |
79 (39.9) |
23 (46.0) |
|
|
Lymphovascular invasion |
|
|
0.433 |
|
(+) |
119 (60.1) |
27 (54.0) |
|
|
(-) |
79 (39.9) |
23 (46.0) |
|
|
Retrieval LN (no.) |
24.9 |
23.1 |
0.359 |
|
Positive LN (no.) |
5.49 |
5.62 |
0.917 |
Table 2.
Operative data and short-term outcome
|
Variable |
Open surgery (n = 198) |
Laparoscopic surgery (n = 44) |
P-value |
|
Operation performed |
|
|
0.314 |
|
Right hemicolectomy |
63 (31.8) |
15 (34.1) |
|
|
Left hemicolectomy |
5 (2.5) |
1 (2.3) |
|
|
Anterior resection |
51 (25.8) |
17 (38.6) |
|
|
Low anterior resection |
23 (11.6) |
6 (13.6) |
|
|
Lowest anterior resection |
2 (1.0) |
0 |
|
|
Hartmann’s procedure |
47 (23.7) |
3 (6.8) |
|
|
Abdominoperineal resection |
5 (2.5) |
1 (2.3) |
|
|
Subtotal colectomy |
1(0.5) |
0 |
|
|
Total colectomy |
1 (0.5) |
1 (2.3) |
|
|
Postoperative complications |
26 (13.1) |
3 (6.7) |
0.312 |
|
Ileus |
3 (1.5) |
1 (4.0) |
|
|
Wound problem |
6 (3.0) |
1 (2.0) |
|
|
Infection |
3 (1.5) |
0 |
|
|
Stoma problem |
1 (0.5) |
0 |
|
|
Hematochechia |
1 (0.5) |
1 (2.0) |
|
|
Voiding difficulty |
2 (1.0) |
0 |
|
|
Bed sore |
1 (0.5) |
0 |
|
|
CV complication |
6 (3.0) |
0 |
|
|
Mortality |
3 (1.5) |
0 |
|
|
Postoperative length of stay (day), mean |
10.4 |
6.7 |
0.048 |
|
Interval from operation to chemotherapy (day), mean |
33.2 |
31.5 |
0.528 |
Table 3.
|
Variable |
Open surgery (n = 198) |
Laparoscopic surgery (n = 44) |
P-value |
|
Chemotherapy performed |
176 (88.9) |
40 (90.9) |
0.521 |
|
Treatment regimen (1st line) |
|
|
|
|
FOLFOX |
26 (13.1) |
7 (15.9) |
|
|
FOLFIRI |
57 (28.8) |
10 (22.7) |
|
|
COX |
5 (2.5) |
2 (4.5) |
|
|
SOX |
12 (6.1) |
5 (11.4) |
|
|
Xeloda |
20 (10.1) |
3 (6.8) |
|
|
XELOX |
34 (17.2) |
10 (22.7) |
|
|
Reject |
22 (11.1) |
4 (9.1) |
|
|
Transfer |
2 (1.0) |
3 (6.8) |
|
|
Others |
20 (10.1) |
|
|
Table 4.
Postoperative chemotherapy
|
Variable |
Open surgery (n = 198) |
Laparoscopic surgery (n = 44) |
P-value |
|
Patients status, no. (%) |
|
|
0.399 |
|
Alive |
40 (20.2) |
13 (29.5) |
|
|
Dead |
153 (77.3) |
30 (68.2) |
|
|
Follow-up loss |
5 (2.5) |
1 (2.3) |
|
|
Survival period (day) |
|
|
0.278 |
|
Median |
646 |
650 |
|
|
Mean |
758 |
851 |
|
|
|






