직장암에서 복강경 수술과 개복 수술 후 단기간의 종양학적 결과에 대한 비교
Comparison of short-term oncologic outcomes following laparoscopic versus conventional open surgery for rectal cancer
Article information
Trans Abstract
Purpose:
The aim of this study was to assess the impact of laparoscopic vs. conventional open surgery for rectal cancer on clinical and oncologic outcome in a multi-modal setting.
Methods:
In total, 940 patients who underwent conventional open surgery between February 1995 and October 2007, and 311 patients who underwent laparoscopic surgery between December 2006 and May 2011 were enrolled retrospectively. Oncologic outcomes included 3-year overall survival (OS) and disease free survival, factors affecting them, and risk factors for local and systemic recurrence.
Results:
No difference was found between laparoscopic surgery and conventional open surgery in terms of OS, disease free survival rate at stages I and II, but the 3-year OS for stage III was different between the groups (70.26% for conventional open surgery vs. 90.14% for laparoscopic surgery; P=0.0002). The 3-year disease free survival rate for stage III was 56.59% for conventional open surgery vs. 56.65% for laparoscopic surgery (P=0.6578). The local recurrence rates were 6.81% vs. 8.47% (conventional open surgery vs. laparoscopic surgery; P=0.4960). The systemic recurrence rates were 15.64% vs. 15.71% (conventional open surgery vs. laparoscopic surgery; P=0.9713).
Conclusion:
Laparoscopic surgery for rectal cancer showed a similar short-term oncologic outcome to conventional open surgery. This suggests that laparoscopic surgery is an acceptable alternative to conventional open surgery for selected patients with rectal cancer.
서론
지난 20년 동안 조기 진단, 수술 전 항암 방사선 요법의 향상 및 전직장간막 절제술[1] 및 수술적 술기의 발전으로 결장직장암의 종양학적 치료 결과가 향상되었다. 결장직장암에서 복강경 수술은 전통적인 개복 수술과 비교하여 보다 적은 통증과 합병증[2-4], 조기 수술 후 회복 및 낮은 수술 후 이환율[5,6], 더 나은 삶의 질[7] 등 우수한 단기결과를 보여주는 것으로 보고되었다.
결장암의 경우에 Barcelona trial (laparoscopy-assisted colectomy versus open colectomy for treatment of non-metastatic colon cancer: a randomized trial) [8], COST trial (clinical outcomes of surgical therapy study) [9], COLOR trial (colon cancer laparoscopic or open resection trial) [10], MRC CLASICC trial (The medical research council conventional versus laparoscopic-assisted surgery in colorectal cancer trial) [11] 등으로 인하여 개복 수술과 복강경 수술이 종양학적 결과(전체 생존율, 무병 생존율, 재발률)에 차이가 없음을 입증하였다.
MRC CLASICC trial에서는 결장암과 직장암이 함께 연구가 시행되었고, 개복 수술과 비교하여 기술적인 면과 종양학적인 면에서 복강경 수술의 안전성과 효용성을 평가하였다[12]. 이 연구에서 직장암의 예후에 중요하다고 알려진 환상 절제연 양성이 복강경 수술군에서 보다 높게 나타나 직장암 복강경 수술에 우려를 표하였으나 환상 절제연 양성률의 차이가 국소 재발률의 차이로 이어지지는 않았다.
그럼에도 여전히 직장암에 대한 복강경 수술의 종양학적 안정성에 대하여는 논란의 소지가 있으며 이로 인하여 현재는 직장암에 대해 COLOR II trial [13], Japan Clinical Oncology Group 0404 trial, American College of Surgeons Oncology Group (ACOSOG)-Z6051 trial [14] 등의 여러 연구가 진행 중이지만, 국내에서는 아직 그 보고가 많지 않은 실정이다.
방법
1995년 2월부터 2007년 10월까지 인제대학교 부산백병원 외과에서 개복 수술을 통한 종양특이 직장간막절제술을 시행받고 병리 조직 검사상 I, II, III기(American Joint Committee on Cancer [AJCC], 6th ed.)에 해당하는 직장암 환자 940명과 2006년 12월부터 2011년 5월까지 복강경 수술을 시행받은 직장암 환자 311명을 대상으로 분석하였다. 수술 전 원격전이가 있는 환자, 근치적 절제가 불가능한 환자, 수술 전 carcinoembryonic antigen (CEA)가 조사되지 않은 환자, 종양이 항문연과 떨어진 위치에 대한 기술이 없는 환자는 본 연구에서 제외하였다.
임상자료는 본원의 의무기록과 전향적으로 대장항문외과 데이터 베이스에 등록된 기록을 바탕으로 후향적으로 조사하였다. 본 연구에서 직장암은 에스결장경 검사로 항문연에서 15 cm 이내에 위치하고 병리 조직검사상 선암종으로 확인된 pT1 이상인 경우로 위치에 따라 하부(항문연에서 6 cm 이내), 중부(항문연에서 7-12 cm), 상부(항문연에서 13-15 cm)로 분류하였다. 생존율 조사를 위한 사망자 확인은 중앙 암 등록 본부의 자료를 바탕으로 조사하였다.
합병증으로 조사된 문합부 누출은 수술 후 임상적으로 고열과 복통, 배액관에서 분변 배액, 말초 혈액검사상 백혈구의 증가 등으로 상부 전환 장루 조성술을 시행한 경우로 정의하였다. 또한, 환상절제연 침범은 가장 깊게 침범한 종양과 절제연과의 거리가 1 mm 이하인 경우로 정의하였다[15].
수술 후 화학방사선 보조요법은 수술 후 병리 조직검사상 II, III기에 해당하는 환자들 중 림프절 전이가 있거나, 혈관 및 림프절 침윤이 있거나, 절제연 양성이 의심되는 환자에 대해 선별적으로 시행하였으며 70세 이상인 경우나 도시와 떨어진 농어촌에 거주하여 방사선 치료 받기를 거부한 노령의 환자들은 제외하였다. 항암 화학 요법은 수술 후 4주 이내에 Mayo 요법으로 5-fluorouracil 425 mg/m2와 leucovorin 20 mg/m2를 정맥주사로 연속 5일간 정주하여 한달 간격으로 6회 반복 시행하였다.
추적 조사로는 수술 후 3개월 간격으로 혈청 CEA를 검사했고 6개월 간격으로 흉부 X선을 촬영했으며 매년 복부 전산화 단층촬영, 흉부 전산화 단층촬영, 대장내시경을 시행하였다. 외래 정기 추적관찰 중 재발의 진단은 내시경 조직검사 및 경피적 생검을 이용하여 병리조직학적으로 진단하였으며, 조직병리학적 검사가 불가능한 경우에는 전산화단층촬영, 양전자방출단층촬영 등의 방사선학적 검사로 진단하였다.
통계학적 분석은 SAS ver. 9.2 (SAS Inc., Cary, NC, USA)를 이용하였다. 생존분석은 다변량 분석으로 Cox-proportional hazard model을 사용하였으며 그룹 간의 차이는 log-rank test을 이용하였다. 명목 변수들은 카이제곱 검정이나 Fisher exact test를 이용하였다. 양측 검정을 원칙으로 하며 P값이 0.05 미만인 경우 통계적으로 의미 있게 평가하였다.
결과
임상, 병리적 특성
개복 수술을 시행받은 전체 940명의 환자 중 남자는 509명(54.15%), 여자는 431명(45.85%)이었으며 평균 연령은 59.15세(27-96세)였다. 한편, 복강경 수술을 시행받은 전체 311명의 환자 중 남자는 193명(62.06%), 여자는 118명(37.94%)이었으며 평균 연령은 62.58세(28-89세)였다(Table 1).
항문연으로부터 종양하연까지의 평균거리는 개복 수술군과 복강경 수술군에서 각각 8.03 cm (범위, 1-15 cm)와 8.87 cm (범위, 1-15cm)로 수술방법은 복회음절제술 246명(26.17%)과 27명(8.68%), 저위전방절제술 652명(69.36%)과 280명(90.03%), 초저위전방절제술 13명(1.38%)과 4명(1.29%)이었으며, 하트만 수술은 개복 수술군만 26명(2.77%)이었다(Table 1).
수술 후 문합부 누출은 개복 수술군과 복강경 수술군에서 각각 11명(1.17%)과 4명(1.29%)이었으며, 수술 전 항암화학방사선요법을 시행한 경우는 39명(4.15%)과 29명(9.32%)이었고, 수술 후 항암화학방사선요법을 시행한 경우는 206명(21.91%)과 40명(12.86%)이었다 (Table 1).
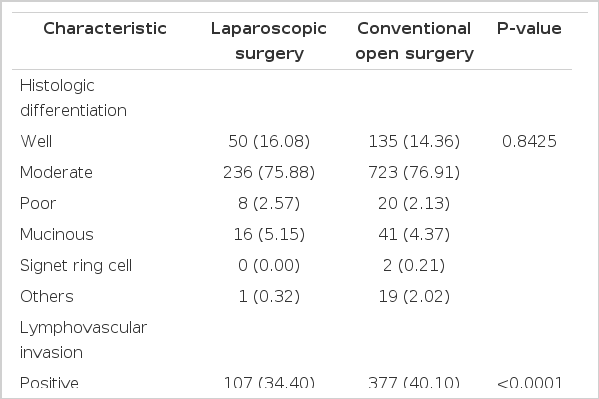
조직학적 분류는 개복 수술군과 복강경 수술군에서 고분화도 선암 135명(14.36%)과 50명(16.08%), 중분화도 선암 723명(76.91%)과 236명(75.88%), 저분화도 선암 20명(2.13%)과 8명(2.57%), 점액성 선암 41명(4.37%)과 16명(5.15%), 반지세포암은 개복술군에서만 2명(0.21%)이었다(Table 2).
병리조직 검사에서 혈관 혹은 림프관 침윤은 각각 377명(40.10%)과 107명(34.40%), 원위부 절제연 거리는 2.16 cm와 2.11 cm이었으며, 절제연 양성은 7명(0.74%)과 1명(0.32%)이었다. 환상 절제연 양성은 53명(5.64%)과 7명(2.25%)으로 두 군 간 통계학적으로 유의한 차이를 보였다(P= 0.0154) (Table 2).
수술 후 병리조직학적 검사에 따른 AJCC 병기는 3기 환자가 개복 수술군과 복강경 수술군에서 418명(44.47%)과 132명(42.44%)으로 모두 가장 많았으며, I기는 230명(24.47%)과 90명(28.94%), II기는 292명(31.06%)과 89명(28.62%)이었다(Table 2).
국소 및 전신 재발 분석
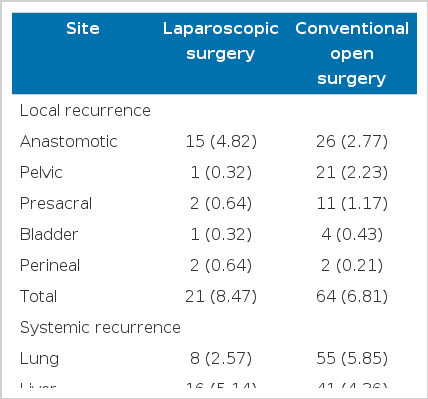
3년 국소 재발은 개복 수술군에서 전체 대상 환자 940명 중 64명(6.81%)으로 나타났으며, 복강경 수술군에서는 전체 대상 환자 311명 중 21명(8.47%)으로 나타났으며, 두 군 간 통계학적으로 유의한 차이는 없었다(P= 0.4960) (Fig. 1). 재발 부위로는 개복 수술군에서는 문합부 재발이 26명(2.77%)으로 가장 높았고, 골반강 내 재발이 21명(2.23%), 천골부위 재발이 11명(1.17%)의 순으로 발생하였으며, 복강경 수술군에서는 문합부 재발이 15명(4.82%)으로 가장 높았다(Table 3). 국소 재발에 대한 위험 인자의 다변량 분석 결과, 개복 수술군은 나이(P=0.0190), pT 병기(P=0.0480), 조직학적 분화도(P=0.0469), 원위부 절제연 양성(P< 0.001), 환상 절제연 양성(P= 0.0004)등이 의미 있는 인자였고, 복강경 수술군에서는 성별(P = 0.0287), 혈관 혹은 림프관 침윤(P = 0.0273)이 의미 있는 인자였다(Table 4, Table 5).

Local recurrence rate (A) and systemic recurrence rate (B) (laparoscopic surgery vs. conventional open surgery).
3년 전신 재발은 개복 수술군에서 전체 대상환자 940명 중 147명(15.64%)이었으며, 복강경 수술군에서는 전체 대상환자 311명 중 41명(15.71%)이었고, 두 군 간 통계학적으로 유의한 차이는 없었다(P=0.9713) (Fig. 1). 재발 부위로는 개복 수술군은 폐전이가 55명(5.85%)으로 가장 높았고, 간전이 41명(4.36%), 뼈 전이 20명(2.13%)의 순으로 발생하였으며, 복강경 수술군에서는 간전이가 16명(5.14%)으로 가장 높았으며, 폐전이가 8명(2.57%), 대동맥 주위 임파절 전이 7명(2.25%) 순이었다(Table 3). 국소재발과 전신 재발이 동시에 발생한 경우는 개복 수술군에서는 32명(3.4%)이었으며 복강경 수술군은 4명(1.29%)이었다. 전신 재발에 대한 위험 인자의 다변량 분석의 결과는 개복 수술군에서는 pT병기(P=0.0069), pN병기(P< 0.001)가 의미 있는 인자였으며, 복강경 수술군에서는 pN병기(P< 0.001), 문합부위 누출(P=0.0091) 등이 의미있는 인자였다(Table 4, Table 5).
생존율 및 예후 인자 분석
병기에 따라 생존율을 분석하였을 때, I기에서 3년 전체 생존율은 개복 수술군 94.74%, 복강경 수술군 98.89% (P= 0.1636)이었으며, 무병 생존율은 개복 수술군 92.98%, 복강경 수술군 93.49% (P= 0.9700)로 모두 통계학적인 의미가 없었다(Fig. 2). II기에서 3년 전체 생존율은 개복 수술군 86.39%, 복강경 수술군 92.91% (P= 0.1512)로 나타났으며, 무병 생존율은 개복 수술군 78.57%, 복강경 수술군 79.18%(P= 0.8769)로 역시 통계학적인 의미는 없었다(Fig. 3).
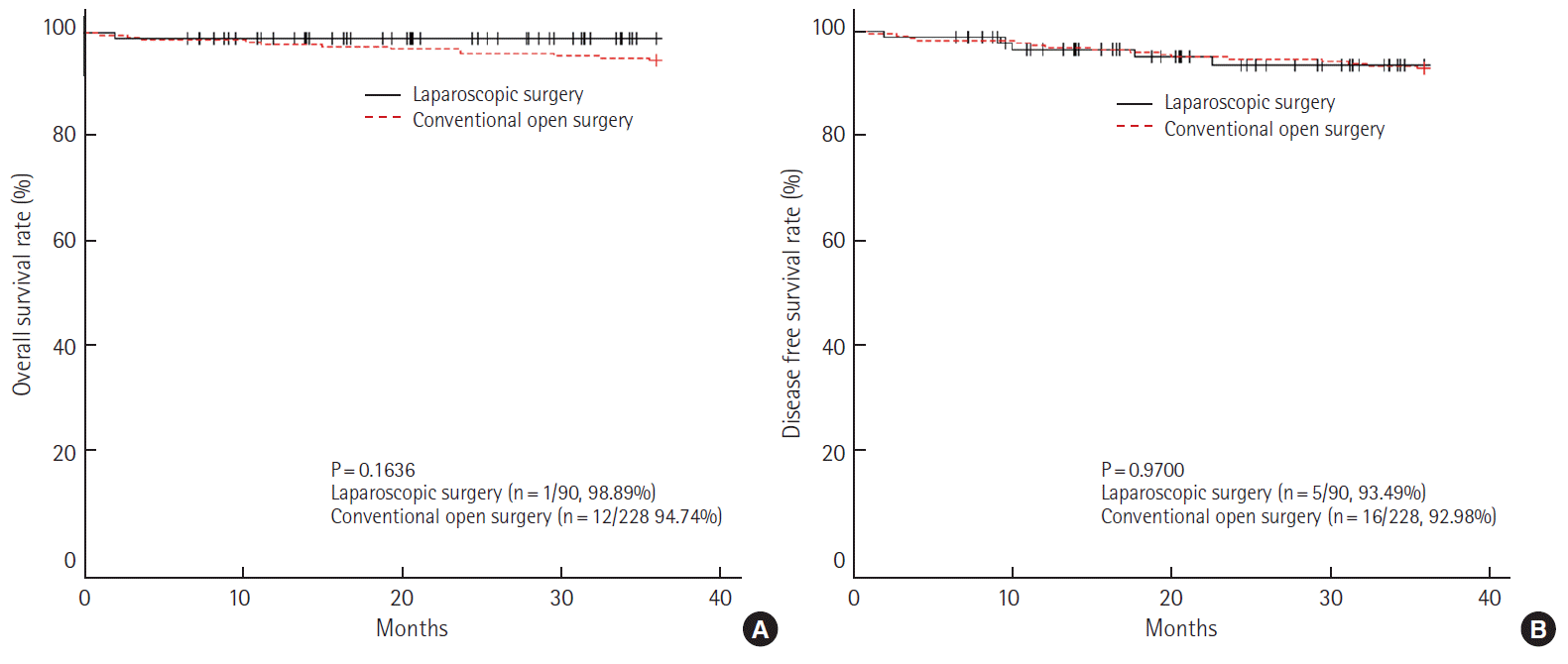
3-year overall survival rate (A) and disease free survival rate (B) at pathologic stage I (laparoscopic surgery vs. conventional open surgery).
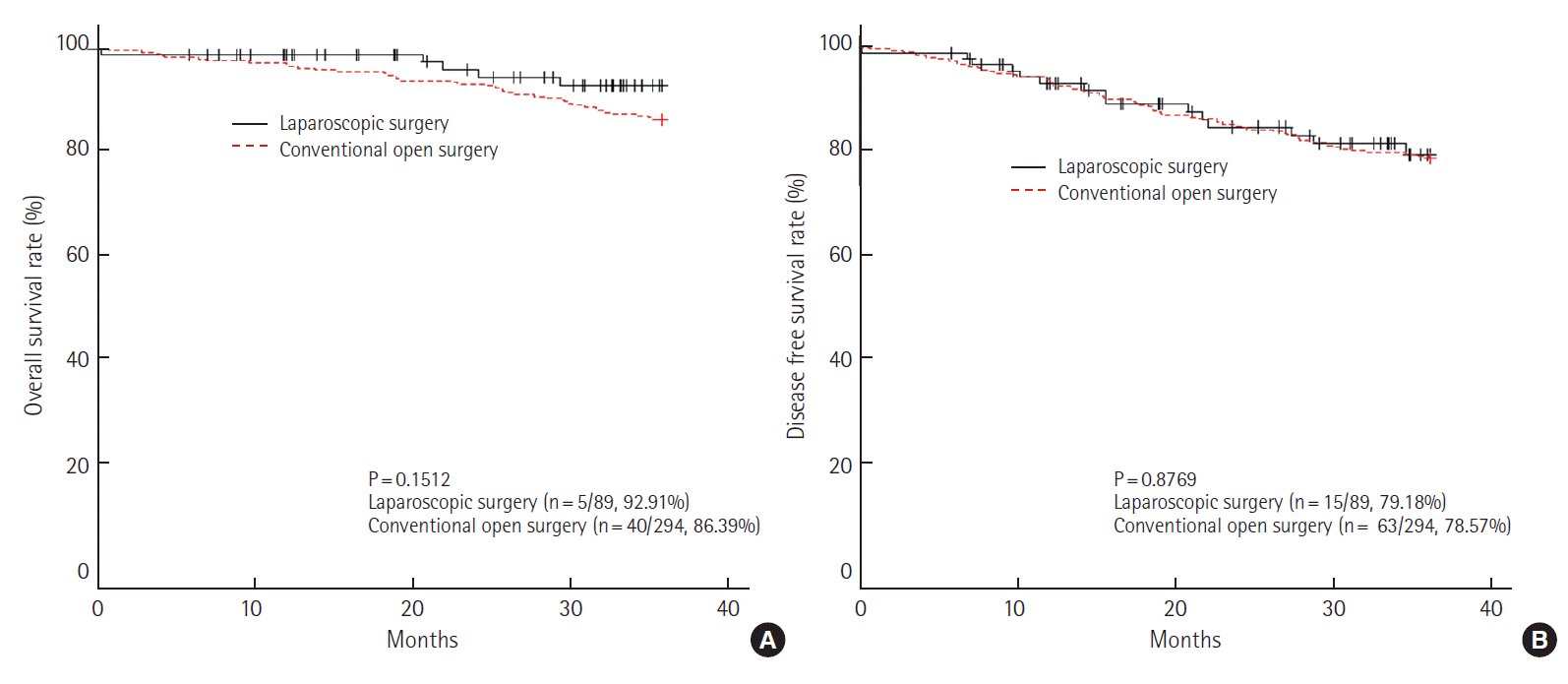
3-year overall survival rate (A) and disease free survival rate (B) at pathologic stage II (laparoscopic surgery vs. conventional open surgery).
III기에서는 3년 전체 생존율이 개복 수술군에서는 70.26%, 복강경 수술군이 90.14% (P= 0.0002)로 통계학적으로 유의한 차이를 보였으나, 무병 생존율에서는 개복 수술군이 56.59%, 복강경 수술군이 56.65% (P= 0.6578)로 통계학적인 차이가 없었다(Fig. 4). III기를 세분화하여 IIIA, IIIB, IIIC로 구분하여 생존율을 다시 분석하였으며, IIIA에서는 3년 전체 생존율(개복 수술군 vs. 복강경 수술군, 86.67% vs. 93.75%, P= 0.5527)과 무병 생존율(개복 수술군 vs. 복강경 수술군, 83.33% vs. 72.82%, P= 0.4011)에서 개복 수술군과 복강경 수술군이 모두 통계학적인 차이를 보이지 않았으나(Fig. 5), IIIB에서 3년 전체 생존율을 분석하였을 때, 개복 수술군이 77.40%, 복강경 수술군이 96.69% (P= 0.0023)로 통계학적인 차이를 보였다(Fig. 6). IIIC에서는 IIIA와 마찬가지로 3년 전체생존율(개복 수술군 vs. 복강경 수술군, 59.89% vs. 75.78%, P= 0.1709)과 무병 생존율(개복 수술군 vs. 복강경 수술군, 43.41% vs. 25.89%, P= 0.0626)에서 통계학적인 차이는 없었다(Fig. 7).
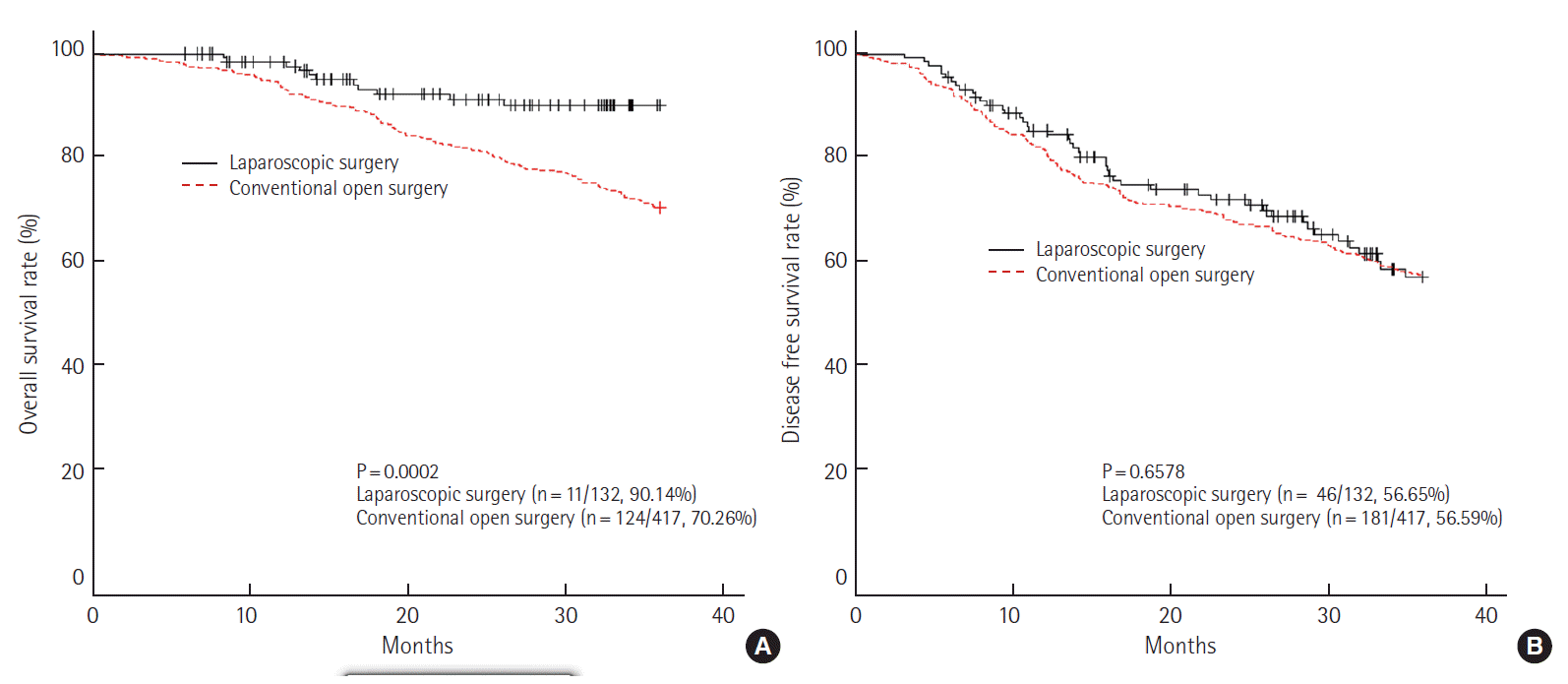
3-year overall survival rate (A) and disease free survival rate (B) at pathologic stage III (laparoscopic surgery vs. conventional open surgery).

3-year overall survival rate (A) and disease free survival rate (B) at pathologic stage IIIA (laparoscopic surgery vs. conventional open surgery).
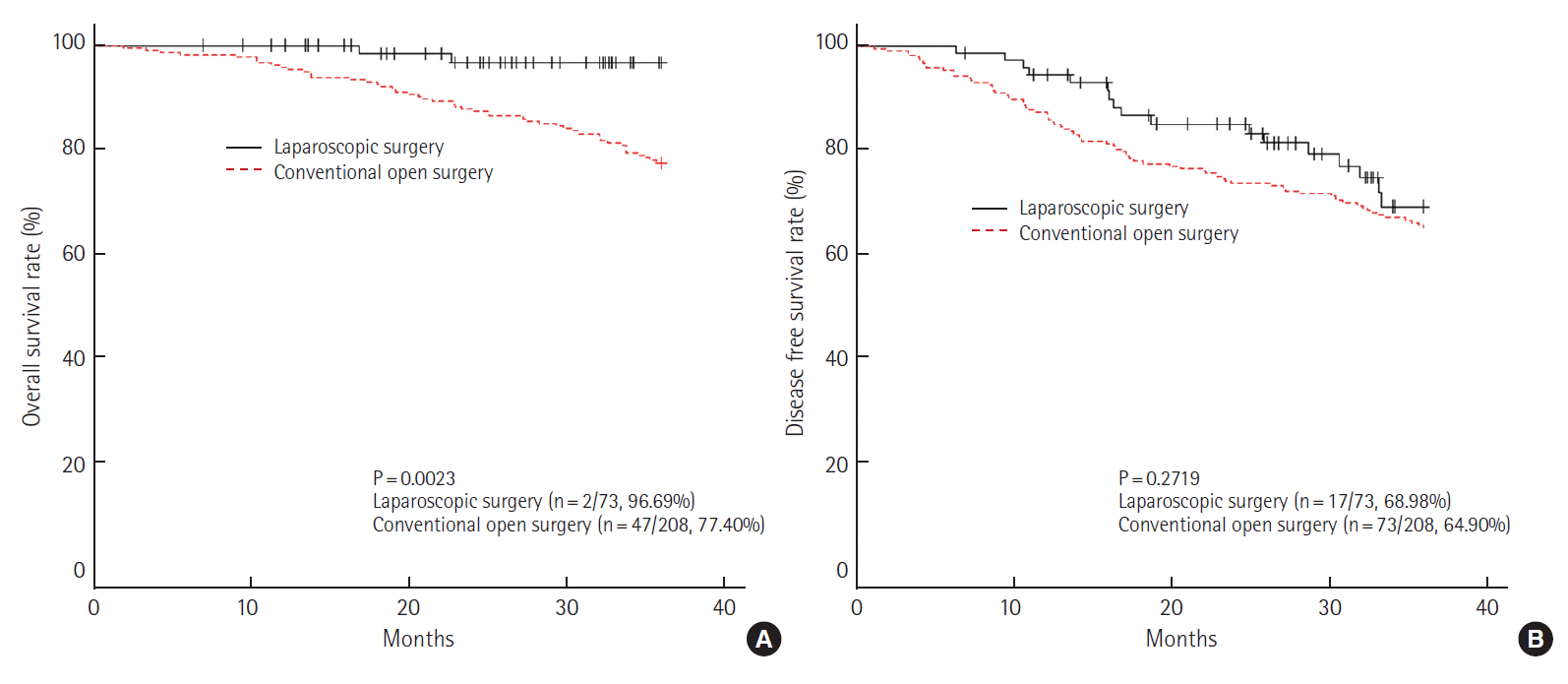
3-year overall survival rate (A) and disease free survival rate (B) at pathologic stage IIIB (laparoscopic surgery vs. conventional open surgery).

3-year overall survival rate (A) and disease free survival rate (B) at pathologic stage IIIC (laparoscopic surgery vs. conventional open surgery)
한편 무병 생존율에 대한 예후 인자의 다변량 분석에서는 개복 수술군에서 pT병기(P= 0.0002), pN병기(P< 0.0001), 수술 전 혈청 CEA 증가(P= 0.0174), 원위부 절제연 양성(P= 0.0030) 등이 의미 있는 인자였고, 복강경 수술군에서는 성별(P= 0.0108), pN병기(P< 0.0001), 혈관 및 림프절 침윤(P= 0.0242), 문합부 누출(P= 0.0126) 등이 의미 있는 인자였다(Table 4, Table 5).
고찰
복강경 수술은 1985년 독일의 Erich Muhe에 의하여 담낭절제술에 처음으로 적용되었고, 점차 적용 범위가 확대되어 현재는 거의 모든 복부수술에 적용되고 있다[16]. 결직장 수술에도1991년 Jacobs 등 [17]에 의하여 복강경 절제술이 처음 시도된 이래 초기의 보고들은 복강경 수술이 수술 후 환자의 회복을 빠르게 하고 합병증 발생을 낮춘다고 주장하였으나, 악성 질환의 경우 절개 부위의 재발 비율이 높게 보고되면서 이와 같은 주장들은 종양학적 면에서는 부정적으로 받아들여졌다.
하지만, 이후 복강경 기구와 수술 술기의 향상으로 결장암 복강경 수술에 대한 여러 대규모 연구에서 복강경 수술은 종양학적 안정성을 보여주게 되었다. 결장암에서 복강경 수술과 개복수술을 비교한 Barcelona trial [8]에서는 219명의 환자를 대상으로 추적 관찰한 결과 결장암에서 복강경 수술군이 수술 후 이환율 및 재원일수, 무병 생존율(복강경 vs. 개복, 91% vs. 79%; P= 0.02)에 있어서 개복 수술군보다 더 효과적으로 나타났으며, 재발률의 경우는 복강경 수술군과 개복 수술군이 17%와 27% (P=0.07)로 통계학적인 유의성은 없으나 복강경 수술군에서 보다 재발률이 낮은 경향을 보였다. COST trial [9] 또한 48개 센터에서 872명의 환자를 대상으로 하여 재발률(복강경 vs. 개복, 17.5% vs. 19.6%; P= 0.32) 및 전체 생존율(복강경 vs. 개복, 82.5% vs. 80.4%; P=0.51)과 무병 생존율(복강경 vs. 개복, 27.1% vs. 27.3%; P= 0.70)이 복강경 수술군과 개복 수술군을 비교하여 통계학적으로 유의한 차이가 없음을 확인하여 결장암에서 복강경 수술이 개복수술과 비교하여 종양학적 안정성을 입증하였다.
그러나, 직장암의 경우에는 대부분의 전향적인 연구에서 제외되어 복강경 직장암 수술의 종양학적인 안전성에 대한 기준이 마련되어 있지 않은 상태였으며, 전향적 다기관 연구였던 MRC CLASSIC trial에서 794명의 결장직장암 환자를 대상으로 하여 연구가 진행되었고, 직장암을 포함한 종양학적 결과가 2007년[11]과 2010년[12]에 발표되면서 직장암 복강경 수술도 처음으로 안전성을 확인하게 되었다.
또한, 최근 Kang 등[7]에 의해 이루어진 COREAN trial에서 직장암으로 진단받고 개복 수술을 시행받은 170명과 복강경 수술을 시행받은 170명을 각각 비교 분석하여 수술 전 화학 방사선 요법을 시행 후 복강경 수술을 받은 환자군이 환상 절제연 양성 및 전직장간막 절제술의 질, 림프절 절제 수, 이환율 등에서 개복 수술군과 차이가 없고, 수술 중 실혈량이 적을 뿐 아니라 장의 회복이 빠르고 조기 식이 및 진통제의 적은 사용이 가능하며 생리적인 기능에서 개복 수술군보다 우월함을 보고하였다.
최근 국내외의 대부분 의료기관에서 직장암 수술에 복강경 수술을 적용하는 비율이 증가하고 있으며, 여러 기관에서 종양학적인 안정성에 대한 연구는 현재도 여전히 진행중인 상태이다. 이에 저자는 본 연구에서 직장암의 복강경 수술에 대한 종양학적 안정성을 확인 하고자 하였다.
환상 절제연의 확보는 전직장간막 절제술의 중요한 목적 중의 하나로[18], 환상 절제연 양성은 국소재발을 예견하는데 중요한 부분을 차지하고 있다[19]. MRC CLASICC trial [12]에서는 개복 수술군 6.3%, 복강경 수술군에서 12.4%로 복강경 수술군에서 환상 절제연 양성률이 다소 높았으나 통계학적인 의미는 없었으며 5년 경과추적 결과 또한 국소 재발률의 차이(개복 수술, 7.6%; 복강경 수술, 9.4%; P= 0.740)를 보이지는 않았다. 본 연구에서는 환상 절제연 양성률이 개복 수술군에서 53명(5.64%)로 나타났고, 복강경 수술군에서는 7명(2.25%)로 복강경 수술군에서 환상 절제연의 확보가 좀 더 잘 이루어지는 것으로 확인되었다(P= 0.0154).
본 연구에서 국소 재발은 개복 수술군과 복강경 수술군에서 각각, 6.81%와 8.47% (P= 0.4960)으로 두 군 간 통계학적으로 유의한 차이가 없었다. MRC CLASICC trial [11]의 경우 직장암 복강경 수술군의 재발률은 9.7%로 보고되며 이는 본 연구의 결과와 유사하다. Leroy 등[20]은 102명의 직장암 환자에서 90예의 근치적 복강경 절제술을 시행하였으며 평균 36개월의 관찰에서 국소 재발률이 6%를 보였다. 본 연구의 국소 재발률이 다른 연구들과 비슷하거나 약간 높은 경향을 보이는데 이는 병기가 II기 이상인 환자에서 보조적 화학 방사선 요법을 시행한 비율이 낮아서 나온 결과로 추정한다.
2004년도에 이러한 화학 방사선 보조요법을 수술 전에 시행하였을 때와 수술 후에 시행하였을 때를 비교한 German Rectal Cancer Trial [21]에서 5년 국소 재발률이 각각 13% (수술 후 치료군)와 6% (수술 전 치료군)로 나타나 선행 보조 화학 방사선치료의 효율성이 입증되었으며 2009년에 이르러서는 미국 NCCN의 지침에 선행 보조 화학방사선 치료가 T3 병변이거나 영역 림프절 전이가 의심되는 임상적 II기와 III기에서의 표준치료로 정식 발표되었다. 이 지침에 의해서 본원에서는 환자의 나이, 수행능력, 경제적 능력, 병원과의 접근성 등을 고려하여 보조적 화학 방사선 요법을 시행하였나, 2009년 이전에 수술 받은 환자수가 많았기 때문에 화학 방사선 요법을 시행받은 비율이 상대적으로 낮았으며 이러한 인자가 국소 재발률에 영향을 미쳤으리라 생각한다.
수술 전에 임상병기가 II기나 III기에 해당하는 직장암 환자의 경우 선행 보조 화학 방사선 요법을 시행 하는 것을 원칙으로 하여 치료계획을 세울 때는 수술 시행 까지 휴지기간에 반응이 없는 20%의 환자에서는 전신적으로 암이 퍼질 수 있다는 점과 방사선 치료가 불필요한 환자에게 과잉치료가 될 수 있다는 점들을 염두에 두어야 할것이며, 선행요법을 시행하지 못한 경우는 수술 후 병리조직 검사상 II기 이상에 해당할 경우 수술 후 보조 화학방사선 요법을 반드시 시행하는 것이 국소 재발률을 줄이는데 도움이 되리라 판단한다.
본 연구에서 전신 재발은 개복 수술군과 복강경 수술군에서 각각 15.64%와 15.71% (P= 0.9713)로 두 군 간 통계학적 차이가 없었으며, MRC CLASICC Trial [11]의 경우도 전신 재발률이 18.6%로 본 연구의 결과와 유사하다. 본 연구에서 복강경 직장 절제술의 국소 재발에 대한 위험인자는 성별(P= 0.0287)과 혈관 혹은 림프관 침윤(P=0.0386)으로 나타났으며, 이 요소는 다른 전직장간막 절제술 연구와 비슷하다[22-24]. 현재 전신재발의 위험인자로 성별, 병기, 환상 절제연, 수술 전 혈청 CEA 수치가 알려져 있으며 본 연구의 경우 pN 병기(P< 0.0001), 문합부위 누출(P= 0.0091) 등으로 나타났다. 전신 재발이 환자의 생존율 및 삶의 질에 아주 큰 영향을 미치게 되므로 앞서 언급한 위험인자들이 있을 경우 직장암 수술 후 적극적인 보조적 화학요법이 필요할 것으로 생각한다.
본 연구의 직장암 개복 수술군과 복강경 수술군의 전체 생존율은 각각 I기 94.74%와 98.89% (P=0.1636), II기 86.39%와 92.91% (P= 0.1512), III기 70.26%와 90.14% (P= 0.0002)이며 무병 생존율은 각각 I기 92.98%와 93.49% (P= 0.97), II기 78.57%와 79.18% (P= 0.8769), III기 56.59%와 56.65% (P= 0.6578)이다.
III기의 경우 전체 생존율이 각 군에서 70.26%와 90.14% (P=0.0002)로 통계학적 차이를 보였다. III기의 경우 세분화하여 조사하였는데, IIIA기는 전체 생존율과 무병 생존율에서 통계학적으로 의미있는 차이가 없었으며, IIIB기에서는 전체 생존율이 각 군이 77.40%와 96.69% (P= 0.0023)으로 의미있는 차이를 보였고, 무병 생존율에서는 개복 수술군과 복강경 수술군이 64.90%와 68.98% (P= 0.2719)로 통계학적으로 의미있는 차이가 없었다. 한편, IIIC기에서는 전체 생존율에서 59.89%와 75.78% (P= 0.1709), 무병 생존율에서 43.41%와 25.89% (P= 0.0626)로 통계학적인 의미가 없었다. III기 중 가장 흔한 IIIB기에서 통계학적인 차이를 보인 것은 복강경 수술의 특성상 복잡하고 비좁은 골반 내의 해부학적 구조를 비디오 영상을 통해 근접, 확대하여 볼 수 있어 좀 더 세밀하고 정확한 수술이 가능하며, 제한된 공간에서 종양을 직접 만지지 않으면서 수술 시행이 가능하기 때문으로 생각한다[25]. 본 연구 결과에서도 복강경 수술군에서 환상 절제연 확보가 용이하였으며, 침윤성 직장암의 예후에 환상 절제연 침윤 여부가 아주 중요하다고 알려져 있으므로[26], 환상 절제연 확보가 전체 생존율에 영향을 끼쳤으리라 생각된다.
Lezoche 등[27]은 복강경 직장암 수술 후 평균 추적 관찰기간 78개월에 전체 생존율 71%를 보고하였으며, Lee 등[28]은 전체 생존율에서 I기의 경우 90.2%, II기의 경우 84%, III기의 경우 57.6%를 보고하였다. 본 연구가 다른 직장암 복강경 수술에 대한 연구보다 더 우수한 성적을 보였는데, 이것은 본 연구의 관찰기간이 짦음으로 인한 결과로 예상된다. 하지만 Joh 등[29]이 시행한 연구에서는 3년 무병생존율이 병기당 각각 I기 100%, II기 88.6%, III기 56.9%로 본 연구와 비슷한 결과를 보고하였다.
결론적으로 본 연구에서 직장암의 복강경 수술과 개복수술을 비교한 결과 복강경 직장 절제술에 종양학적 안정성이 있음을 확인하였다. 현재 본 연구는 환자 수의 불균형, 짧은 추적관찰, 각 군의 수술 시기가 다른 점 등 후향적인 연구의 제한점이 존재한다. 그러므로 보다 나은 종양학적 결과를 도출하기 위해서는 보다 많은 환자 군의 추가와 추후 장기간의 관찰 및 다기관의 연구가 필요하다.
본 연구 결과, 직장암에 대한 복강경 수술은 수술 후 회복 및 이환율에 있어서의 장점을 갖고 있을 뿐만 아니라, 개복 수술과 비교하여 유사한 정도의 단기적인 종양학적 결과를 나타내고 있다. 따라서 직장암에 대한 복강경 수술이 선택적인 환자군에서 전통적인 개복 수술을 대체할 수 있다. 아울러 직장암 환자를 대상으로 한 복강경 수술의 효과에 대해 장기적인 연구결과를 도출하기 위하여 지속적인 연구가 필요하다.
Notes
No potential conflict of interest relevant to this article was reported.