충수돌기에서 기인한 고등급 복막가성점액종의 반복적인 용적축소수술의 임상적 고찰
Surgical treatment for high-grade pseudomyxoma peritonei originated from appendix: Analysis of clinical outcomes of repeated debulking surgery
Article information
Trans Abstract
Purpose
To evaluate the effect of repeated debulking surgery for high-grade pseudomyxoma peritonei (PMP) originating from the appendix.
Methods
Between January 1998 and December 2014, fifty patients, who underwent debulking surgery for high-grade PMP originating from the appendix, were obtained from a prospectively collected database and retrospectively analyzed. Two groups according to the number of operations were divided and analyzed.
Results
A total of 118 operations were performed. Thirty-one patients received more than two operations. The median interval between operations was 18.2 months (range, 2–170 months). Complications developed after 26 operations (22.0%), including ileus (n=10), intra-ab-dominal fluid collection (n=7), surgical site infection (n=5), and others. There were two mortalities within 30 days after operation. Between two groups of patients who received one operation only and patients who received more than two operations, transfusion, diversion operation, and postoperative complication rate showed statistically significant differences. Two groups of patients had no differences in overall survival rates.
Conclusion
Our results indicate that the number of operations does not affect the survival rate of high-grade appendiceal PMP, in which repeated debulking surgery is vital to relieve symptoms of the tumor burden.
서 론
복막가성점액종(pseudomyxoma peritonei, PMP)은 복강 내 점액성 종양이 침착되는 질환으로[1], 연간 발생률이 백만 명당 1–2명인 매우 드문 질환이다[2]. 질병의 원인은 대부분 충수돌기에서 유래하는 것으로 알려져 있으며[3,4], 치료는 보존적 치료[5]부터 종양의 제거 후 전신항암치료[6,7]까지 다양한 방법이 시도되어 왔으나 생존율의 향상은 명확하지 않다. 근래에 Sugarbaker에 의해 세포감퇴수술(cytoreductive surgery, CRS)과 동시에 복강 내 온열항암화학요법(hyperthermic intraperitoneal chemotherapy, HIPEC)이 소개된 이후 그 결과가 생존율 상승에 효과적이라고 보고된 바 있다[8]. 그러나 고등급 복막가성점액종으로 국한하여 살펴보면 종양의 광범위한 주변 장기로의 침투로 잔여 종양을 2.5 mm 이내로 제거가 불가능한 경우에 해당 술식의 적용은 제한이 있다[9]. 결국 진행된 고등급 복막가성점액종 환자에서는 반복적 용적축소수술이 생존율의 증가를 기대할 수 있는 치료법이 될 수 있으나 이에 대한 수술 후 임상적 예후에 대한 근거는 빈약하다[10].
따라서 이 연구는 충수돌기에서 기인한 고등급 복막가성점액종 환자의 반복적 용적축소수술에 영향을 미치는 인자에 대한 분석 및 용적축소수술에 따른 생존율을 도출함으로써 반복적 용적축소수술의 임상적 의미에 대해 평가하고자 한다.
방 법
1998년 1월부터 2014년 12월까지 충수돌기에서 기인한 고등급 복막가성점액종으로 수술을 받은 환자 50명을 대상으로 전향적으로 모집된 의무기록을 후향적 분석하였다. 본 연구는 임상시험계획심사위원회(Institutional Review Board) 승인을 받았다(승인번호: 1610-037-797).
연구를 위해 수집한 인자는 다음과 같다. 첫 번째 수술 시행 당시 연령, 성별, 첫 번째 수술 당시 체질량지수(body mass index), 수술 전 혈액 내 종양표지자 수치(암종배아항원: carcinoembryonic antigen [CEA]; carbohydrate antigen 19-9 [CA 19-9]), 첫 번째 수술의 방법, 수술 횟수, 첫 수술 당시의 복막종양지수(peritoneal carcinomatosis index, PCI), 수술 시간, 수술 중 실혈량, 수혈 여부, 병리조직학적 등급, 수술 후 합병증, 수술 후 사망, 수술 후 전신항암화학요법의 유무, 수술 후 마지막 관찰 기간, 사망 여부 등을 전자의무기록을 통해 수집하였다. 본 연구에 속한 환자들은 최소 한 번 이상 본원에서 수술적 치료를 받았으며, 모든 수술에서 원발 부위의 절제 혹은 모든 종양의 절제가 불가능한 경우 최대한의 용적축소수술을 시행하였다. 첫 번째 수술의 목적은 암종의 완벽한 절제 혹은 이미 완벽한 절제가 불가능할 경우에는 장기의 기능 보존과 복부 팽만, 호흡 곤란 등의 복강 내 종양의 크기 효과에 따른 증상을 완화시키기 위한 것이었다. 소장 간막을 침윤한 복막가성점액종에 대하여 국소적일 경우 소장 절제 및 문합을 시행하였고, 이미 광범위하게 퍼져있어 종양 제거의 의의가 없을 경우에는 장관 연결성 유지에 초점을 맞추어 점액성 종양을 최대한 제거하는 수술을 시행하였다. 기본적으로 넓게 퍼져있는 복막가성점액종에 대해 복막 절제술을 시행하지 않았으나, 국소적으로 복막에 종양이 있는 경우에는 그 부분의 복막만 절제하는 것을 원칙으로 하였다. 수술 후 경과 관찰 중 종양의 부피 증가로 인하여 호흡 곤란, 일상 생활이 불가능 할 정도의 복부 팽만이 나타나거나 암종의 소장 및 대장의 침투로 기계적 장 폐색 등의 증상이 발생하는 경우 재수술을 진행하였다. 수술 후 합병증은 수술일 30일 이내 발생한 것으로 정의하였으며 장 마비는 수술 후 5일 이후까지 구역, 구토 등의 증상의 발현으로 보존적인 치료를 시행하거나 혹은 식이 진행이 되지 않으면서 영상학적 검사에서 장 마비측정되었으며 첫 번째 수술과 두 번째 수술 사이 기간 에 부합한 소견을 보이는 경우로 정의하였다. 창상 합병증에는 창상의 재 봉합술을 시행한 경우도 포함하였으며 그 외 복강 내 농양 또는 체액 축적 등이 조사되었다. 수술 후 사망은 수술 후 같은 입원기간 내의 사망을 모두 포함하였다. 종양의 부피와 분포 정도는 수술 시 소견에 따라 기록된 복막종양지수로 측정되었다[11]. 수술을 한 번만 받은 환자와 두 번 이상 받은 환자를 두 군으로 구분하여 위의 인자들과 연관성의 차이에 대한 분석을 시행하였다.
수술의 횟수에 따라 나눈 두 군의 비교는 비연속 변수의 경우 카이 제곱 검정으로 분석하였고 연속 변수 중 정규분포를 따를 경우 독립 T검정을 정규분포를 따르지 않을 경우 비모수검정인 Mann-Whitney 검정을 하였다. 두 군의 전체 생존율은 카플란-마이어 생존 분석을 이용하여 산출하였으며 P-값은 로그-랭크 분석을 이용하였다. 통계학적 분석을 위해 SPSS ver. 21.0 (IBM Co., Somers, NY, USA)을 사용하였으며, P값이 0.05 미만인 경우 통계학적으로 유의하다고 정의하였다.
결 과
임상적 특성
환자들의 임상병리학적 특성은 Table 1에 나타내었다. 평균 추적 기간은 64.0개월(범위, 6.8–213.6개월)이었고, 평균연령은 57.5세였다. 성별로는 여자 33명, 남자 17명으로 여자에서 높은 빈도를 보였다. 한 번의 수술만 받은 환자는 19명이었으며 두 번 이상의 수술을 받은 환자는 31명이었다. 수술 사이 기간의 중앙값은 18.2개월(범위, 2–170개월)로 측정되었으며 첫 번째 수술과 두 번째 수술 사이 기간은 31.8개월, 두 번째 수술과 세 번째 수술 사이 기간은 21.0개월, 세 번째 수술과 네 번째 수술 사이 기간은 13.2개월로, 수술 사이 기간은 수술 횟수가 누적될수록 짧아지는 경향을 보였다. 첫 번째 수술은 우측결장절제술(32예, 64.0%)을 가장 흔히 받았으며, 전결장절제술, 자궁 및 양측난소절제술, 대망절제술 순서로 시행되었다. 장루 형성술은 총 21예(42.0%)에서 시행되었으며, 회장루가 17예(34.0%), 결장루가 4예(8.0%)로 분포하였다. PCI의 중간값은 27.0 (범위, 6.0–36.0)으로 측정되었다. 수술 시간의 중간값은 155분(범위, 45–330분)이었으며, 수술 중 실혈량의 중간값은 535 mL (범위, 50–4,200 mL)이었고, 27예(54.0%)에서 수혈이 시행되었다. 전신항암화학요법은 모두 44예(88.0%)에서 시행되었다. 전신항암요법은 대부분 플루오로피리미딘 기반의 항암치료를 시행했으며(41예, 93.2%) 용법은 다음과 같았다. 플루오로피리미딘 단독 투약이 8예, 옥살리플라틴과 혼합하여 투약이 16예, 시스플라틴과 혼합하여 투약이 14예, 이리노테칸과 혼합하여 투약이 2예가 있었다. 6명의 환자에서 전신항암화학요법이 시행되지 않았는데, 이는 환자의 거부 또는 전신적 건강상태의 저하 등의 이유로 전신항암화학요법이 제한된다고 판단한 경우였다. 본 연구에 포함된 모든 환자에서 복강 내 항암화학 요법은 시행되지 않았다.
수술 후 이환율과 사망률
총 118건의 수술 중 26예(환자수=15, 22.0%)에서 수술 후 합병증이 발생하였으며, 장 마비가 10예, 복강 내 체액 축적이 7예, 수술 부위 감염이 5예, 문합부 누출이 4예, 폐렴이 2예 등이었다. 수술 부위 감염 5예 중 2명의 환자에서 수술 부위 재 봉합을 시행하였다. 문합부 누출 4예의 경우, 모두 복강 내 체액 축적이 동반되었다. 5명의 환자는 복강 내 체액 축적과 장 마비가 동시에 발생하였으며, 2명의 환자는 폐렴과 장 마비가 동시에 발생하였다. 복강 내 체액 축적과 수술 부위 감염, 장 마비와 수술 부위 감염이 동시에 발생한 환자가 각 1명씩 있었으며, 흉수, 복강 내 체액 축적 및 장 마비가 동시에 발생한 환자가 1명 있었다. Table 2에 합병증에 대해 정리하였다. 수술 후 사망률은 1.7% (2예)로 나타났으며. 모두 급성 호흡곤란 증후군으로 사망하였다. 첫 번째와 다섯 번째 수술 후 폐렴이 발생한 후 급성 호흡곤란 증후군으로 진행되어 사망하였으며 수술 후 117일과 26일째 사망하였다.
수술 횟수에 따른 두 군의 비교
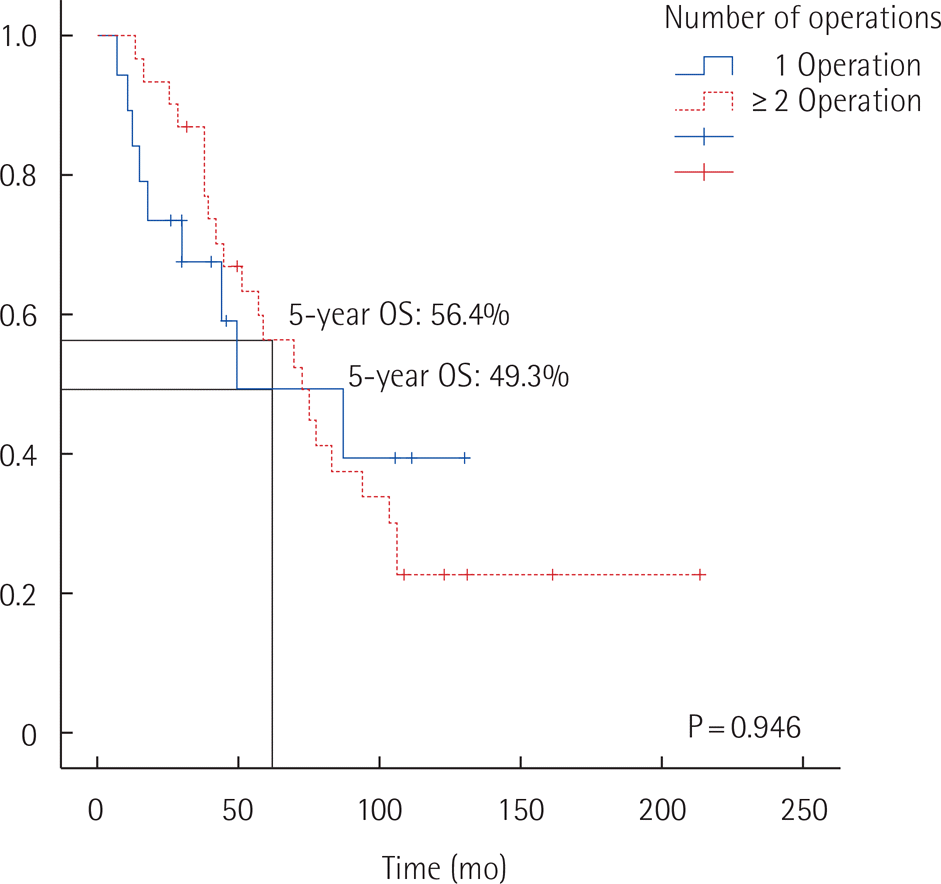
수술을 한 번 받은 환자들과 두 번 이상 받은 환자들을 두 군으로 구분하여 다른 인자와의 관계에 대하여 Table 3에 정리하였다. 나이, 성별, 수술 전 종양표지자(CEA, CA19-9), PCI, 수술 시간, 수술 중 실혈량, 전신항암치료의 여부, 대장절제 유무는 재수술에 연관성을 보이지 않았다. 두 군에서 수혈 여부(OR, 9.74; P=0.002), 장루 형성 유무(OR, 7.69; P=0.043)와 수술 후 합병증 유무 (OR, 6.14; P=0.026)가 유의한 차이를 보였다. 수술을 한 번 받은 환자들과 두 번 이상 받은 환자들 간의 전체 생존율은 차이가 없었다. 수술을 한 번 받은 환자군의 5년 생존율은 49.3%, 10년 생존율은 39.4%였고, 두 번 이상 받은 환자군의 5년 생존율은 56.4%, 10년 생존율은 22.6%였다(Log rank P=0.946) (Fig. 1).
고 찰
본 연구에서는 충수돌기에서 기인한 고등급 복막가성점액종 환자에서 수술 후 임상결과를 분석하였다. 평균 환자의 나이는 57.5±11.7세이고 상대적으로 여성에서 많이 발생하였다. PCI의 중간값은 27.0 (6.0–36.0)이며, 두 번 이상 수술을 시행한 환자는 31명(62%)이었다. 수술 후 합병증은 26예(22.0%)에서 나타났다. 수술을 한 번 시행한 군과 두 번 이상 시행한 군을 비교분석 하였을 때 재수술과 관련된 인자는 수혈, 장루 형성여부, 합병증 발생여부가 있었다. 생존분석 결과, 두 군의 전체 생존율의 차이는 보이지 않았다.
기존 연구들에 의하면 재수술에 영향을 미치는 인자는 잔여 종양의 유무, 합병증 발생 여부가 보고된 바 있다[12,13]. 본 연구에서 수술 횟수에 따라 재수술을 받은 환자들과 받지 않은 환자들로 나누어 분석을 시행한 결과 수술 후 합병증 발생 유무가 재수술과 연관성이 있다고 분석되었다. 이는 반복된 수술로 합병증이 누적되어 유의하게 분석된 결과로 고려된다. 수혈 및 장루 형성 여부가 재수술과 통계적으로 관련이 있다고 분석된 것은 이 인자들이 재수술에 영향을 미치는 것이 아니라 수술이 반복됨에 따라 수술의 난이도가 상승하여 수혈의 필요성과 장루 형성 빈도가 높아지는 것을 의미한다. 그 외 일반적으로 종양의 예후와 관련이 있다고 알려진 CEA, CA 19-9 [14], PCI [15], 그리고 전신항암요법[6,16] 여부는 재수술과 관련성을 보이지 않았다. 이는 본 연구에서 포함된 모든 환자들은 이미 1차 혹은 2차 병원에서 충수돌기와 관련된 수술을 시행하고 점액종의 광범위한 복막 전이가 존재한 상태로 본 병원에 방문하였거나 첫 방문에서부터 주변으로의 복막전이가 존재한 상태로 용적축소수술을 받았기 때문에 특이성이 떨어지는 것으로 판단된다. 그러나 잔여 종양의 유무 그리고 첫 수술 시 복강 내 상태에 대한 정확한 정보는 PCI를 제외한 기록을 의무기록에서 수집할 수 없어 추가적인 분석은 제한되었다.
고등급과 저등급 복막가성점액종의 특성에 대해 보고된 바에 의하면 고등급 복막가성점액종의 경우 림프의 전이가 많으나 장기침범의 경우 저등급 복막가성점액종과 비교할 때 통계학적 차이가 없었다[17]. 결국 충수돌기에서 기인한 고등급 복막가성점액종의 경우 림프절 절제술이 예후에 영향을 미칠 가능성을 예측할 수 있다. 본 연구에서 분석한 결과는 대장 절제와 동시에 림프절 절제를 구획으로 시행한 환자들과 단순 대망절제술 혹은 자궁 및 양측난소절제술을 시행한 환자들 간의 재수술에 관하여 연관성을 보이지 않았다(P=0.332).
세포감퇴수술의 정의는 2.5 mm 이상의 종양을 모두 제거하는 것을 목적으로 하며[9], 용적축소수술은 종양 및 추가적인 절제를 통해 장관 연결성을 확보하고 최대한 종양을 제거하여 종양의 양적 효과를 감소시켜 전체적인 종양의 부담을 줄이는 것이 목표인 수술 방법으로 두 가지 수술의 목적이 다르다고 볼 수 있다. 최근 들어 복막가성점액종에서 CRS와 HIPEC이 이상적인 치료법으로 대두되었지만, 근치적 절제로 인한 높은 합병증 발생률[6], 복강 내 직접적인 항암제 주입으로 인해 발생할 수 있는 심각한 문제점[18] 등 아직까지 적용하기에 어려운 점이 많다. 진행된 복막가성점액종 환자에서 CRS를 할 수 없을 경우, 반복적 용적축소수술이 중요한 치료 방법이 될 수 있다. 반복적 용적축소수술을 시행한 선행 연구 결과, 5년 생존율은 15%에서 65%로 다양하였고, 질환의 병리조직학적 등급에 따라 5년 전체 생존율의 유의한 차이가 있었다[16]. 생존율에 영향을 미치는 인자에는 수술 전 종양표지자, 종양 등급도 등이 제시되었다[19]. 본 연구에서 반복적 용적축소수술의 횟수에 따른 전체생존율 비교 분석을 하였으나 그 차이는 보이지 않았다. 수술을 한 번 받은 환자군의 5년 생존율은 49.3%, 10년 생존율은 39.4%였고, 두 번 이상 받은 환자군의 5년 생존율은 56.4%, 10년 생존율은 22.6%였다(P=0.946). 하지만, 본 연구에 포함된 환자들이 복막가성점액종이 진행되어 전신항암치료가 효과를 보이지 않고[20] 재수술이 불가피한 상황에서 수술했다는 점을 고려할 때, 반복적 용적축소수술이 시행된 군이 한 번 수술 받은 환자군과 동일한 생존기간을 보장한다는 점에서 종양의 부피 증가로 인한 호흡 곤란, 일상 생활이 불가능할 정도의 복부 팽만, 그리고 종양의 장관 침투로 인한 기계적 장폐색 등의 수술적 적응증을 보이는 환자에서 반복적이고 적극적인 수술적 제거가 안전하고 유용한 치료의 한 방안임을 제시한다.
고등급 복막가성점액종의 경우 기존 연구에서 보고된 합병증은 출혈, 복강 내 농양, 상처 감염, 장 마비, 요도 감염 등이 알려져 있다[21]. 본 연구에서도 총 합병증은 22.0%로 관찰되었다. 각 환자에서 수술 횟수가 증가할수록 주로 복강 내 체액 축적, 문합부 누출, 수술 후 복막염, 폐렴 등이 증가하는 추세였다. 반복된 용적축소수술에 따른 심한 유착으로 수술 시 제한이 있었으나, 종양의 특성상 점액성 물질은 다른 암종 수술에 비하여 상대적으로 유착 정도가 덜하였으며 전문적 술기에 능한 한 명의 집도의에 의해 모든 수술이 진행되었다. 모든 의사에게 적용될 수는 없는 결과인 점이 제한점이지만, 복막가성점액종의 특성상 적극적인 수술이 중요하다는 점에서 의의가 있다. 한 번 수술한 군과 두 번 이상 수술한 군으로 나누어 비교하였을 경우, 두 번 이상 수술한 환자군에서 합병증 발생률이 유의하게 높았지만(OR, 6.14; P=0.026), 합병증의 유무는 생존율에 영향을 미치지 않았다(P=0.946). 이는 수술이 반복됨에 따라 합병증이 누적되어 통계적으로 유의하게 분석된 것으로 판단할 수 있으며, 적극적인 수술 전후 환자 관리로 단기간 내 합병증을 극복하면 장기간 생존율의 향상도 기대해 볼 수 있을 것이다.
본 연구의 장점은 충수돌기에서 기인한 고등급 복막가성점액종만을 대상으로 하여 그 임상적 경과에 대해 자세히 알 수 있으며, 해당 질환의 반복적인 용적축소수술의 예후에 대해 명확히 제시하고 있다. 제한점으로 첫째, 후향적 연구이다. 이와 관련된 자료의 미비 및 수집 관련 오류가 존재한다. 둘째, 분석된 환자의 수가 적어 질환의 실질적인 임상경과를 대변한다고 볼 수 없다. 마지막으로 3차 병원에서 시행한 연구로 고도로 진행된 환자가 편중되어 일반적인 의료 현장을 대변하지 못하는 오류의 발생이 가능하다.
결론적으로 충수돌기에서 기인한 고등급 복막가성점액종의 반복적인 수술 횟수는 수혈, 장루 형성여부 및 합병증 발생여부와 관련되었으나, 수술을 반복적으로 시행하는 군과 수술을 한 번만 시행한 군의 생존율의 차이는 보이지 않았다. 이는 생명을 위협하는 증상이 발생할 경우 적극적인 반복적 용적축소수술을 시행하는 것이 치료의 중요한 방법임을 제시한다.
CONFLICT OF INTEREST
No potential conflict of interest relevant to this article was reported.