체질량 지수가 대장암 환자의 생존율에 미치는 영향
Impact of body mass index on overall survival after surgery for colorectal cancer
Article information
Trans Abstract
Purpose
The studies on the impact of obesity on survival for colorectal cancer (CRC) in Korea are still insufficient. The aim of this study is to evaluate body mass index (BMI) as a prognostic factor of CRC.
Methods
From January 2006 to December 2008, a total of 1873 patients with CRC who underwent surgery at Seoul National University Hospital were included in this study. Study participants were divided into five BMI groups: underweight (<18.5 kg/m2), normal weight (18.5–22.9 kg/m2), overweight (23–24.9 kg/m2), obese (25–29.9 kg/m2) and morbidly obese (≥30 kg/m2). Clinicopathological variables and survival data were reviewed retrospectively. Overall survival was analyzed using log-rank test and Cox regression analysis.
Results
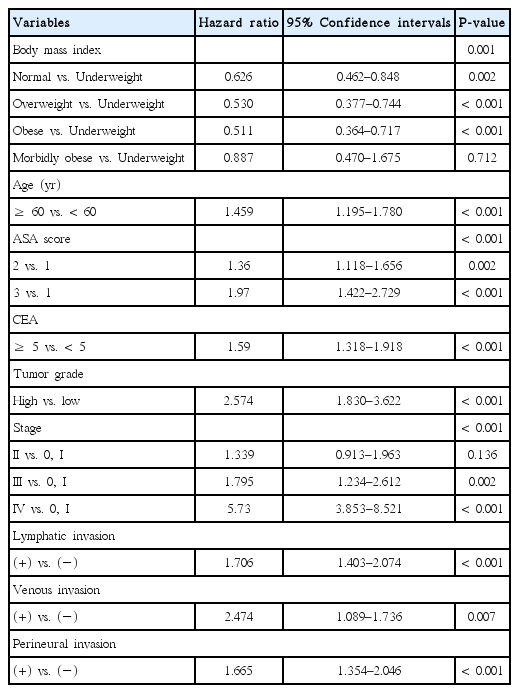
Overall survivals of underweight, normal weight, overweight, obese, and morbidly obese groups were significantly different (5-year overall survivals rates: 54.4%, 73.2%, 78.6%, 77.2%, and 53.8%, respectively; P<0.001). In multivariable analysis for overall survival, BMI was an independently significant risk factor. Normal weight, overweight, and obese groups had lower hazard ratios for overall survival than underweight group (hazard ratio [HR], 0.626; 95% confidence interval [CI], 0.462–0848, P=0.002; HR, 0.530, 95% CI, 0.377–0.744, P<0.001; HR, 0.511, 95% CI, 0.470–1.675, P<0.001, respectively). The hazard ratio of morbid obese group was not significantly different from that of underweight group (HR=0.887, 95% CI=0.470–1.675, P=0.712).
Conclusion
BMI can be a prognostic factor for CRC in Korea. Underweight and morbidly obese were associated with poor overall survival. Large multicenter studies in the Korean population is needed for a definite conclusion.
서 론
대장암은 국내 발생률에서 갑상선, 위암에 이어 3번째로 흔한 암(12.3%, 2013년 기준)이며, 암사망률 4위(전체 암 사망자 중 11%)로 전 세계적인 발생률, 사망률과 비슷한 양상을 보인다[1–3].
대장암의 발생 위험인자에 대해서는 수 많은 연구가 진행되어 왔고, 다양한 대장암 발생의 위험 인자들이 밝혀져 있다. 이 중 높은 체질량 지수(body mass index, BMI)는 남녀 성별에 따라 기여도가 다르기는 하지만, 동서양 인종에서 공통적으로 대장암의 발병률을 높이는 것으로 알려져 있다[4–8].
하지만, 진단 당시 체질량 지수가 대장암 환자에서 생존 결과에 미치는 영향에 대해서는, 전 세계적으로 다양한 연구들이 시행된 바 있으나 아직까지 일관된 결과를 보이지는 못하고 있으며 [9–16], 인종 및 성별에 따라 체질량 지수가 생존율에 미치는 영향이 다르게 나타나기도 한다[17–21]. 하지만 아시아계에 대한 연구, 특히 한국인에서 연구는 부족한 실정이다[22–25]. 본 연구에서는 한국인 대장암 환자에서 체질량 지수가 생존율에 어떤 영향을 미치는지 규명하기 위한 목적으로 시행하였다.
방 법
2006년 1월 1일부터 2008년 12월 31일까지 서울대학교병원 외과에서 대장에 발생한 원발암으로 수술을 받은 환자 중, 유전성 대장암으로 진단된 경우를 제외한 총 1,873명을 대상으로 하였다.
원내 전자의무기록을 통해 진단 당시 체질량 지수를 포함한 당뇨, 고혈압, 심혈관 질환의 과거력 및 음주, 흡연 여부, American Society of Anesthesiologists (ASA) class 및 수술 전 암태아성항원(carcinoembryonic antigen) 수치, 병리 검사결과, 수술 후 보조치료 여부 및 생존 기간 등을 후향적으로 수집하였다.
아시안에 대해 World Health Organization에서 지정한 체질량 지수 기준에 따라 환자군을 저체중(<18.5 kg/m2), 정상체중(18.5–22.9 kg/m2), 과체중(23–24.9 kg/m2), 비만(25–30 kg/m2), 병적비만(≥30 kg/m2)의 다섯 그룹으로 분류하였다[26].
전체 생존율을 분석하기 위해 생존기간은 수술일을 기준으로 마지막 추적 관찰일 또는 사망일까지로 계산하였다. 전체 생존율은 Kaplan-Meier 방법을 이용하여 산출하였다. 전체 생존율에 미치는 위험 인자에 대해 단변량 분석으로 log-rank test를 이용하였다. 단변량 분석에서 통계적으로 의미 있는 변수를 다변량 분석에 포함시켰다. 다변량 분석은 Cox 회귀 분석을 이용하였다. 통계 처리는 IBM SPSS Statistics ver. 20 (IBM Co., Somers, NY, USA) 프로그램을 이용하였고, P 값이 0.05 미만일 때 통계적으로 의미 있는 것으로 간주하였다.
결 과
환자들의 체질량 지수에 따른 임상병리학적 특성은 Table 1과 같다. 전체 환자들의 진단 시 평균연령은 61.5세이고, 남자의 비율은 63.2%였다. 저체중인 환자가 전체의 6.7%였고, 과체중 환자가 23.9%, 비만인 환자는 22.0%, 병적 비만인 환자는 1.39%를 차지했다. BMI가 높은 군 일수록 고혈압의 유병률 및 ASA class 2의 빈도가 통계적으로 유의하게 높아지는 양상을 보였다. 저체중군 및 병적 비만군에서 수술 전 carcinoembryonic antigen (CEA)가 5 이상인 비율이 높았다. 종양의 분화도, 병기, 림프관 침습, 혈관 침습에서는 그룹 간에 차이가 없었다. 저체중군 및 병적 비만군에서 신경침윤이 있는 비율이 높았다. 수술 후 항암치료를 받지 않은 환자의 비중은 저체중군에서 가장 높았다.
92개월의 추적관찰기간 동안 전체 환자에서 5년 전체생존율은 73.8%였다. 전체생존율에 대해 단변량 분석하였을 때 체질량 지수(P<0.001), 연령(P=0.001), ASA class (P<0.001), 수술 전 암태아성항원 수치(P<0.001), 종양 등급(P<0.001), 병리학적 병기(P<0.001), 림프관 침윤(P<0.001), 정맥 침윤(P<0.001), 신경주위 침윤(P<0.001)이 통계상 유의한 인자였다(Table 2).
저체중군, 정상체중군, 과체중군, 비만군 및 병적비만군에서 5년 전체 생존율은 각각 54.4%, 73.2%, 78.6%, 77.2%, 53.8%로 유의한 차이를 보였다(P<0.001). Kaplan-Meier 생존곡선에서 저체중군 및 병적비만군의 생존곡선이 비슷한 양상을 보이며, 다른 군에 비해 유의하게 낮은 것으로 확인되었다(Fig. 1).
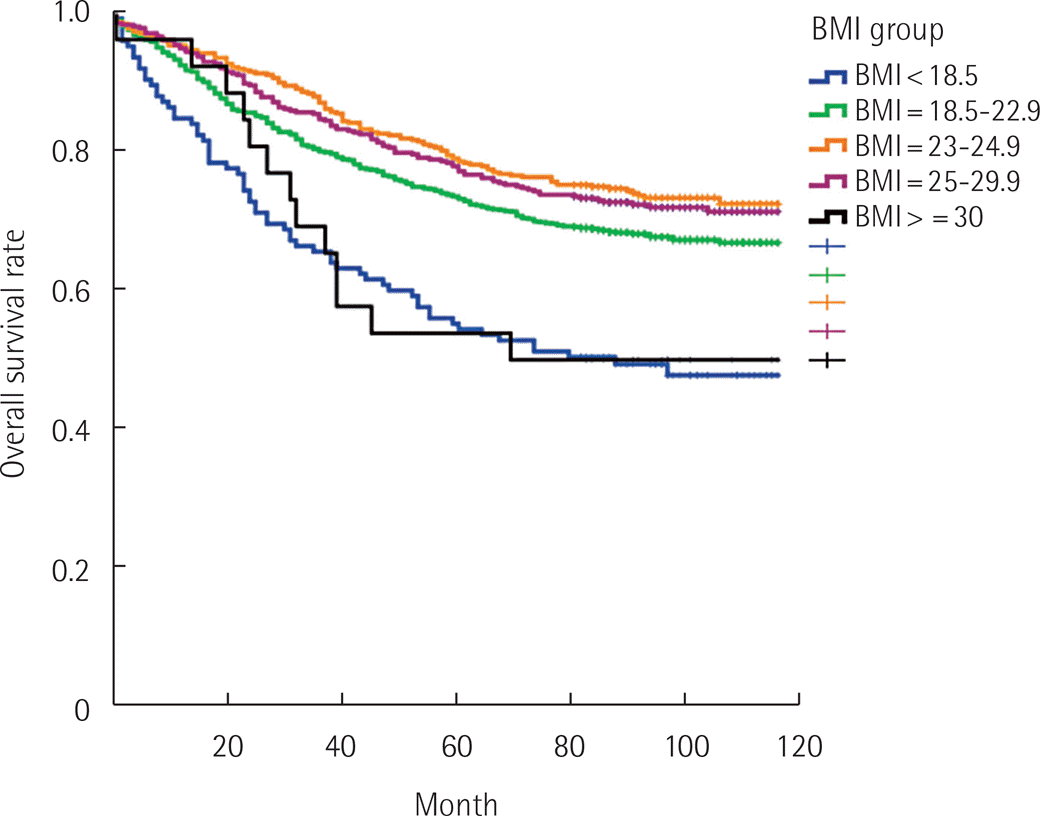
Overall survival graph according to body mass index (BMI) (P<0.001; underweight, BMI <18.5 kg/m2; normal, BMI=18.5–22.9 kg/m2; overweight, BMI=23–24.9 kg/m2; obese, BMI=23–24.9 kg/ m2; morbidly obese, BMI ≥30 kg/m2; underweight vs. normal, P<0.001; underweight vs. overweight: P<0.001; underweight vs. obese, P<0.001; underweight vs. morbidly obese, P=0.817; normal vs. overweight, P=0.018; normal vs. obese, P=0.088; normal vs. morbidly obese, P=0.46; overweight vs. obese, P=0.584; overweight vs. morbidly obese, P=0.003; obese vs. morbidly obese, P=0.008).
전체생존에 대한 다변량 분석에서 통계적으로 유의한 인자는 체질량 지수(P=0.001), 연령 (P<0.001), ASA class (P<0.001), 종양 등급(P<0.001), 병리학적 병기(P<0.001), 림프관 침윤(P<0.001), 정맥 침윤(P=0.007), 신경 침윤(P<0.001)이었다(Table 3).
다변량 분석에서 정상체중군, 과체중군, 비만군은 저체중군에 비해 통계적으로 낮은 위험비를 보였지만(hazard ratio [HR], 0.626; 95% confidence interval [CI], 0.462–0848, P=0.002; HR, 0.530; 95% CI, 0.377–0.744, P<0.001; HR, 0.511; 95% CI, 0.470–1.675, P<0.001), 병적비만군은 저체중군과 유의한 차이를 보이지 않았다(HR, 0.887; 95% CI, 0.470–1.675, P=0.712).
고 찰
본 연구에서는 한국인에서 체질량 지수가 대장암 수술 후 생존율과 연관이 있음을 확인하였다. 체질량 지수와 생존율과의 관계에 대한 기존의 연구결과들은 일관된 결과를 보이지 못하고 있다. Kroenke 등[9]은 BMI 28에서 사망률이 가장 낮은 U자 형태의 생존곡선을 보임을 보고하였고, Lee 등[14]도 저체중 및 비만군에서 높은 사망률을 보인다고 보고하였다. Daniel 등[10]의 연구에서는 진단 시 BMI 35 이상인 환자군에서 사망 위험도가 2–5배 높음을 보였다. Reichle 등[11]의 연구에서는 과체중 환자에서 가장 예후가 좋았고, 비만은 차이가 없었으며, 저체중이 나쁜 예후와 연관이 있었다. Campbell 등[12,16]은 BMI가 증가할수록 사망 위험성이 증가한다고 보고하였다. 이번 연구에서는 저체중군과 병적비만군에서 전체 생존기간이 유의하게 짧음을 관찰하였다. 5년 전체생존율 측면에서 과체중군이 78.6%로 가장 높아 Kroenke 등[9]의 보고와 유사한 양상을 보였다.
아시아인에서 시행된 연구들은 비교적 많지 않은 환자를 대상으로 하였거나, 체질량 지수를 2그룹으로 분류해서 조사한 연구들이 대부분이다[22,24,25]. 본 연구는 대장암으로 진단받은 한국인 남녀 1,873명을 대상으로 World Health Organization 체질량 지수 기준에 따라 5그룹으로 나누어 기존의 연구들에 비해 더 자세히 조사한 장점을 가지고 있다. 아시아인을 대상으로 한 다른 연구들을 살펴보면, Min 등[24]은 509명의 한국인 대장암환자들을 대상으로 시행한 코호트 연구에서, 과체중군에서 전체 생존기간이 유의하게 길었으나, 재발률에는 차이가 없었음을 보고하였다. Park 등[22]은 한국인 186명을 대상으로 시행한 연구에서, BMI에 따른 생존기간의 차이는 보이지 못하였으나, 내장 비만이 낮은 전이 림프절 비율 및 높은 전체 생존율과 연관이 있음을 보고하였으며, 이는 2008년 Moon 등[25]이 보고한 내용과도 일치한다. 중국인 525명을 대상으로 시행한 Liu 등[23]의 연구에서는 BMI 23을 기준으로 정상체중과 과체중군의 전체 생존기간을 비교하였으나 통계적인 유의성을 발견하지 못하였다. Min 등의 연구를 제외한 다른 세 연구에서는 BMI와 전체 생존기간의 연관성을 보이지 못하였는데, 이는 연구대상 환자 수가 적고, BMI에 따른 환자군을 나눌 때 저체중군과 비만군을 따로 나누지 않았기 때문인 것으로 보인다. 이번 연구에서는 체질량 지수와 관련하여 U자 형태와 비슷한 예후를 보였다.
이번 연구에서 과체중군이 가장 좋은 예후를 보이고 있는데 이는 3,408명의 대장암 환자를 대상으로 미국에서 시행된 최근 연구와 비슷한 결과를 보여주고 있다[9]. 체질량 지수 30 kg/m2에서 35 kg/m2인 그룹의 예후가 체질량 지수가 정상인 그룹과 예후가 다르지 않고 체질량 지수 18.5 kg/m2 미만인 그룹과 35 kg/m2 이상인 그룹의 예후가 나빴다. 특히 정상에 비해서 저체중일 때 위험비가 3배에 달했다. 이는 저체중으로 영양상태가 좋지 않을 때가 약간의 비만보다 더 나쁜 예후를 보이는 것을 고려해 볼 때 영양상태가 예후에 중요함을 생각해 볼 수 있다.
본 연구의 한계점은 다음과 같다. 먼저, 사망률을 분석할 때 전체 생존율만을 분석하고, 대장암 이외의 원인으로 사망한 경우를 별도로 분석하지 못하였다. 가령 병적 비만 환자군에서 고혈압 유병률과 ASA class가 통계적으로 높은 경향을 보이며, 이 환자군에서 대장암 이외의 원인에 의한 사망률이 높아 전체사망률이 올라갔을 수 있다. 다음으로, 체질량 지수 외에 허리둘레나 허리-엉덩이비, 내장지방 비율 등 비만도를 측정하는 다른 지표들을 분석하지 못했다. 특히 앞서 Park이나 Moon의 연구에서 보이듯, 체질량 지수가 통계적인 유의미한 차이를 보이지 못하는 경우에도 내장지방 비율을 기준으로 분석할 경우 통계적으로 유의한 결과를 보여, 비만도를 더욱 정확히 반영하는 지표를 이용했을 경우 비만과 대장암 생존율과의 관계를 더욱 정확히 보일 수 있었을 것이다. 향후 이에 대한 보완을 한 연구와 더불어 명확한 결론을 위해서는 단일 기관이 아닌 다기관의 대규모데이터에서 이에 대한 추가 연구가 필요할 것으로 생각된다.
하지만, 본 연구는 한국인을 대상으로 대장암환자의 생존율과 체질량 지수와의 관계를 분석한 연구 중 비교적 많은 환자들을 대상으로 한 연구이며, 다변량 분석에서 기존 연구에 포함되지 않았던 수술 후 항암, 방사선 치료 여부를 포함하여 분석함으로써 기존 연구의 한계를 보완하였다[24]. 이런 점에서 본 연구는 임상적으로 얻기 쉬운 체질량 지수라는 측정치와 대장암 수술 후 전체 생존율과의 관계에 대한 의미 있는 정보를 제공하고 있다.
대장암을 가진 한국인에서 체질량 지수는 유의한 예후인자였고, 저체중 및 병적비만일 때 나쁜 생존율을 보였다. 추후 다 기관의 대규모 데이터에서 이에 대한 추가 연구가 필요할 것으로 생각된다.
CONFLICT OF INTEREST
No potential conflict of interest relevant to this article was reported.
Acknowledgements
This research was partly supported by a grant from the National R&D Program for Cancer Control, Ministry for Health and Welfare, Republic of Korea (grant number 10515608), and partly supported by the Basic Science Research Program through the National Research Foundation of Korea (NRF) funded by the Ministry of Science, ICT & Future Planning, Republic of Korea (grant number 2015008884).
The authors thank Der for the English editing of the manuscript.