유방암 환자의 수술 전 액와림프절 전이 여부 평가를 위한 영상의학적 검사의 효용성
The efficacy of preoperative imaging study for evaluation of axillary lymph node metastasis in patients with breast cancer
Article information
Trans Abstract
Purpose:
The purpose of this retrospective study was to identify the diagnostic performance of positron emission tomography/computed tomography (PET/CT) compared to conventional modalities, such as ultrasonography (US) and contrast-enhanced computed tomography (CT) in detecting axillary lymph node metastasis (ALNM) in patients with breast cancer.
Methods:
Two hundred thirty-three consecutive patients diagnosed with primary breast cancer who had not been treated with neoadjuvant chemotherapy and had been examined by US, CT, and PET/CT before surgery were included. Sensitivity, specificity, positive predictive value (PPV), and negative predictive value (NPV) of each imaging modality and combinations of modality according to tumor size were obtained, and were compared with the histopathological results of sentinel lymph node biopsy or axillary lymph node dissection.
Results:
ALNM was confirmed in 32.6% (76/233) of patients. The sensitivity, specificity, PPV, NPV, and accuracy of US for detecting ALNM were 65.8%, 86.6%, 70.4%, 84.0%, and 79.8%, respectively. The sensitivity, specificity, PPV, NPV, and accuracy of CT were 72.4%, 72.6%, 56.1%, 84.4%, and 72.5%, respectively. The sensitivity, specificity, PPV, NPV, and accuracy of PET/CT were 69.7%, 86.0%, 70.7%, 85.4%, and 80.7%, respectively. The combination of US and PET/CT showed the most accurate results with specificity, PPV and accuracy values of 93.6%, 81.5%, and 82.0%, respectively.
Conclusion:
The diagnostic performance of PET/CT was comparable to that of US and CT. Combination of US and PET/CT could be a reliable strategy for determining preoperative ALNM in patients with operable breast cancer.
서 론
유방암은 서양 여성에서 가장 발병 빈도가 높은 고형암이며, 한국 여성에서도 갑상선암 다음으로 높은 발생 빈도를 차지하고 있다. 최근 유방암 선별검사의 발전과 검진율 증가로 인해 전체 유방암 중에서 조기 유방암이 차지하는 비율이 증가하고 있으며, 이에 따라 수술방법도 유방을 보존하고 수술 범위를 최소화하는 추세이다[1,2]. 그러므로 국소 또는 원격전이 여부에 대한 철저한 검사가 유방암을 치료하고 관리하는 데 있어서 매우 중요하다.
유방암의 예후 인자로는 액와림프절의 전이 여부, 원발 종양의 크기, 조직학적인 아형, 조직학적 등급(histologic grade), 호르몬 수용체 유무 등이 있으며 특히 액와림프절 전이 여부는 유방암 환자에서 재발과 생존율을 예측하는 데 있어 가장 중요한 예후 인자로써 수술 후 항암화학치료나 방사선치료를 결정하는 데 있어서도 중요한 지표로 이용된다[3,4]. 현재까지 액와부 림프절 전이 여부에 대한 평가는 감시림프절 생검술이나 액와림프절 청소술과 같은 수술적인 방법이 가장 정확한 접근법이며, 치료 계획을 세우는 데 있어서 수술 전 액와림프절 상태를 예측 및 평가하는 것이 요구된다[5].
유방암의 진단과 병기설정을 위해서 유방촬영술, 초음파, computed tomography (CT), magnetic resonance imaging (MRI), positron emission tomography/computed tomography (PET/CT) 등의 검사들이 이용되는데 유방암의 초기 평가에 있어 병기설정을 위한 이런 영상의학적 검사는 매우 중요한 역할을 한다[2]. Fluorodeoxyglucose (FDG)-PET/CT는 종양학에서 임상적으로 널리 이용되며 많은 악성종양에 있어서 표준 검사로 받아들여지고 있다[6]. 또한 Wholebody FDG-PET/CT는 유방암에서 병기설정을 하거나 치료 효과를 평가하는 데 있어 점차 사용량이 늘고 있으며 이전에는 몰랐던 전이를 찾아냄으로써 진단적 잠재력이 밝혀지고 있다[5,7,8]. Choi 등[2]의 연구에서는 PET/CT를 이용한 액와부 림프절 병기설정이 전통적인 방법(conventional tool)에 비해 원발병소의 발견율과 병기를 평가하는 데 있어 민감도는 낮지만 액와부 이외 림프절 전이나 원격전이를 발견하는 데에는 이점이 있다고 보고하였다.
액와림프절 병기 설정에 있어 PET/CT와 전통적 방법인 유방초음파나 흉부/유방 CT의 진단적 정확성을 비교한 연구는 아직 보고된 바가 매우 드물며, 국내에서는 보고된 바가 없다. 본 연구는 수술 전 PET/CT, 초음파, CT 검사에서의 액와림프절 전이 여부와 수술 후 조직학적 검사 결과를 비교하여 각각의 검사에 대해 진단적 효용성을 알아보기 위해 시행되었다.
방 법
2012년 1월부터 2014년 12월까지 순천향대학교 부천병원 외과에서 침윤성 유방암으로 수술 받은 환자 중에서 수술 전 항암화학요법을 받지 않았으며, 병기 설정검사로 유방초음파, 유방 CT, PET-CT의 3가지 검사 모두를 시행하고, 수술 중 감시림프절 생검술이나 액와림프절 청소술을 시행한 233명의 환자들을 대상으로 하였다.
유방 초음파
영상의학과 전문의가 iU22 (Philips, Bothell, WA, USA)의 고주파 선형 탐촉자(8–15 MHz)를 이용하여 양측 유방과 액와부에 대해 검사를 시행하였다. 림프절이 원형 또는 불규칙한 모양이거나 지방문의 소실, 저에코의 커진 림프절, 피질의 편심성 비후, 림프절 중심부와 주변부에 미만성 혈류 증가 등의 이상소견이 보이면 의심되는 경우로 판단하여 전이 양성으로 판독하였다[9,10].
CT
CT 검사는 64분할 다중 검출 CT (Light speed VCT XTe, GE Medical Systems, Milwaukee, WI, USA)를 이용하여 시행하였다. 영상 파라미터는 120 kV, 300 mA, 5 mm 두께로 가슴부터 상복부까지 촬영하였다. 초음파를 검사한 영상의학과 전문의가 판독을 하였고, 림프절 피질이 비대칭적으로 두꺼워져 있거나 불규칙한 모양 또는 원형, 지방문의 소실 등의 이상소견이 보이면 전이 양성으로 분류하였다.
PET/CT
PET/CT 스캐너(Siemens Biograph 2, Siemens, Knoxville, TN, USA)를 사용하였고 모든 환자는 8시간 이상 금식을 하였다. 혈중 포도당 농도가 150 mg/dL 이하인 경우에 18F-FDG PET/CT를 시행하였고 검사 시작 1시간 전에 kg 당 18F-FDG 4.4MBq (0.12 mCi)를 정맥 내 주사를 하였다. 저 방사선량의 조영제를 주입하지 않고 촬영하는 CT를 사용하여 attenuation correction을 얻었고 두개골 기저에서 무릎까지를 바로 누운 자세로 촬영하였다. PET/CT 영상은 유방초음파 진단과 결과를 알고 있는 핵의학 전문의가 판독을 하였다. PET/CT에서 18F-FDG 섭취가 배경보다 높을 경우 액와부 림프절 전이를 의심하였다.
액와부 림프절 수술과 조직병리학적 평가
감시림프절 생검을 시행 받는 환자들은 수술 당일 아침 technetium99 phytate 0.5 mCi를 유륜부 주위에 피내 주사 후 유방 림프관 조영술을 시행하여 감시림프절의 개수와 위치를 확인하였다. 수술 중 감마선 검출기(Neoprobe, Dublin, USA)의 탐촉자를 이용하여 액와부에 감마선량을 측정하여 가장 높은 감마선량을 나타내는 림프절을 기준으로 하여, 최고 수치의 10%에 해당하는 감마선량을 보이는 림프절까지를 생검하였다[11]. 감시림프절 생검을 시행한 검체는 수술 중 동결절편검사를 시행하였고, 동결절편 이외의 남은 검체는 포르말린 처리를 하여 영구조직 검사 및 면역조직화학염색을 시행하였다.
통계 분석
액와림프절 전이 유무에 관한 수술 전 초음파, CT, PET/CT 검사 각각에 대한 경우, 서로 병합하였을 경우, 종양의 크기에 따라 나누었을 경우를 수술 후 병리조직검사 결과와 비교하여 민감도(sensitivity), 특이도(specificity), 양성예측도(positive predictive value), 음성예측도(negative predictive value), 정확도(accuracy)를 계산하였다. SPSS ver. 14.0 (SPSS Inc., Chicago, IL, USA)를 사용하여 통계 분석을 하였고, P < 0.05인 경우 통계적으로 의미있는 것으로 해석하였다.
결 과
환자의 임상병리적 특성
환자 나이는 평균 52.9세(범위, 21−80세)였고 유방암의 발생부위는 우측 125명, 좌측 108명이었다. 종양의 크기 별로 구분하였을 때, 2 cm 이하(T1)가 138명(59.2%), 2 cm 초과 또는 5 cm 이하(T2)가 82명(35.2%), 5 cm 초과(T3 이상)가 13명(5.6%)이었다. 임파선 전이가 없는 경우가 157명(67.4%), 전이가 있는 경우가 76명(32.6%)이었고 수술방법은 유방전절제를 시행한 경우가 116명(49.8%), 유방보존술을 시행한 경우가 117명(50.2%)이었다. 액와부 림프절 병기 설정에 있어 감시림프절 생검만 시행한 경우가 158명(67.8%)이었고 감시림프절 생검 후 동결절편검사에서 전이 양성으로 나와 액와부 림프절 청소술을 시행한 경우가 33명(14.2%), 감시림프절 생검 없이 곧바로 액와부 림프절 청소술을 시행한 경우가 42명(18%)이었다. 감시림프절 생검 후 수술 중 동결절편검사에서는 음성이었으나 영구조직검사에서 양성이 나온 경우가 1예 있었다.
종양의 세포형태는 침윤성 관암종(infiltrating ductal carcinoma) 209명(89.7%), 침윤성 소엽암종(infiltrating lobular carcinoma) 12명(5.1%), 점액암종(mucinous carcinoma) 6명(2.6%), 기타 6명(2.6%)이었다. 조직학적 등급(histologic grade)은 1등급 57명(24.5%), 2등급 140명(60.1%), 3등급 36명(15.4%)이었다(Table 1).
영상검사 방법에 따른 액와부 림프절 평가
수술 전 초음파에서 전이 양성이었으나 조직 검사에서 전이 음성으로 나온 경우가 29.6% (21/71)였고, 수술 전 초음파에서 전이 음성이었으나 조직검사에서 전이 양성으로 나온 경우가 16% (26/162)였다(민감도 65.8%, 특이도 86.6%, 양성예측도 70.4%, 음성예측도 84.0%, 정확도 79.8%). CT 검사의 위양성률은 43.9% (43/98), 위음성률은 15.6% (21/135)였다(민감도 72.4%, 특이도 72.6%, 양성예측도 56.1%, 음성예측도 84.4%, 정확도 72.5%). PET/CT에서는 위양성률 29.3% (22/75), 위음성률 14.6% (23/158)로(민감도 69.7%, 특이도 86.0%, 양성예측도 70.7%, 음성예측도 85.4%, 정확도 80.7%), 초음파나 CT와 비교하여 진단적 정확도가 낮지 않은 것으로 나타났다 (Table 2).
각각의 검사를 조합하여 보았을 때, 초음파와 CT 모두에서 전이가 양성이었던 경우는 민감도 61.8%, 특이도 89.2%, 양성예측도 73.4%, 음성예측도 82.8%, 정확도 80.3%였고, CT와 PET/CT 모두에서 전이가 양성인 경우는 민감도 64.5%, 특이도 90.5%, 양성예측도 76.6%, 음성예측도 84.0%, 정확도 82.0%였다. 초음파와 PET/CT 모두에서 양성인 경우, 민감도 57.9%, 특이도 93.6%, 양성예측도 81.5%, 음성예측도 82.1%, 정확도 82.0%였다(Table 2).
초음파, CT, PET/CT 3가지 검사 중 적어도 1가지 이상에서 양성인 경우를 전이 양성이라고 가정하였을 때 민감도 80.3%, 음성예측도 87.4%로 높게 나타났고, 적어도 2가지 이상에서 양성인 경우를 양성이라고 판단하면 민감도 71.1%, 특이도 85.4%, 양성예측도 70.1%, 음성예측도 85.9%, 정확도 80.7%였으며, 3가지 검사 모두 양성이 나올 때를 양성이라고 판단한 경우 특이도 94.3%, 양성예측도 82.7%, 음성예측도 81.8%, 정확도 82.0%로 가장 diagnostic performance가 높은 것으로 나타났다. 또한 이 결과를 종양의 크기에 따라 나누어 분석했을 때, 종양의 크기 2 cm 이하에서 초음파, CT, PET/CT 모두에서 전이 음성이라고 판단하는 경우에 음성예측도가 90.6%로 높게 나타났다(Table 3).

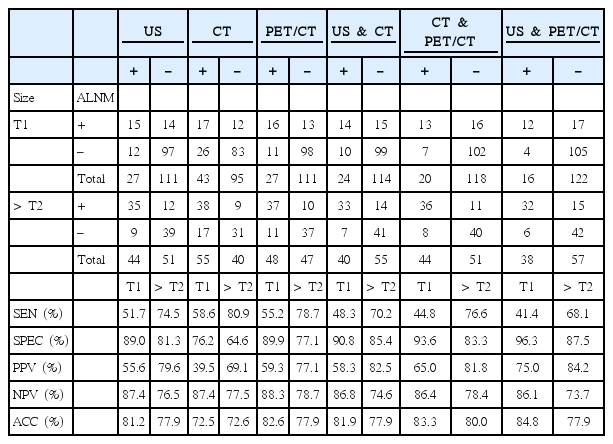
Diagnostic performance of combined modalities according to tumor size when number of cases predicts positive axillary lymph node metastasis
각각의 검사 결과를 원발 종양의 크기에 따라(2 cm 이하, 2 cm 초과) 나누었을 때 3가지 검사 모두에서 종양의 크기가 2 cm 이하인 경우 특이도와 음성예측도가 높게 나타났고, 종양의 크기가 2 cm 초과인 경우 민감도와 양성예측도가 높게 나타났다. 정확도는 초음파와 PET/CT에서는 종양의 크기가 2 cm 이하인 경우 높게 나타났고 CT에서는 종양의 크기에 따른 차이가 없었다(Table 4).
각각의 검사를 원발 종양의 크기에 따라 나누어 2가지씩 검사를 조합하여 보았을 때, 원발 종양의 크기가 2 cm 이하에서는 초음파와 PET/CT 모두 양성인 경우에 특이도가 96.3%로 가장 높았고, 종양의 크기 2 cm 초과에서 초음파와 PET/CT 모두 양성인 경우 양성예측도가 84.2%로 PET/CT 단일인 경우(77.1%) 보다 더 높게 나타났다(Table 4).
고 찰
액와림프절 청소술은 유방암의 수술 시 병기 결정 및 구역 병소 제거의 목적으로 시행되는데, 수술 후 전이된 림프절 개수에 따른 항암화학요법이나 방사선치료를 계획하는 데 중요하다[12,13]. 하지만 이러한 수술로 인한 통증, 림프부종, 또는 신경손상에 의한 감각 및 운동신경 장애 등의 합병증은 삶의 질을 저하시킬 수 있다[14]. 최근 유방암 선별검사의 발전으로 조기 유방암의 비율이 증가함에 따라 액와림프절 전이 음성인 환자의 비율 또한 증가 추세에 있다[1]. 최근에는 대부분 임상적으로 액와부림프절 전이가 음성인 환자에서 감시림프절 검사를 시행하게 되고 동결절편검사에서 음성으로 나온다면 액와부로는 전이가 없다고 판단하여 액와림프절 청소술을 생략한다[4]. 정확한 감시림프절 검사 결과는 유방암의 치료에 진전을 가져다 주는 계기가 되었지만, 감시림프절 생검술 결과가 위음성으로 나오는 경우가 발생하고 있고, 내유림프절이나 쇄골상부 림프절 전이 여부를 판단하는 데 있어 감시림프절 생검술의 결과가 얼마나 기여하는 지에 대한 결론은 아직 없는 상태이다. 이런 이유로 비수술적인 진단 방법이 수술 전 액와부 림프절 침범 범위와 병기를 정확히 예측할 수 있다면 감시림프절 생검이 필요하지 않은 경우를 감별하는 데에는 매우 유용할 것이다[15].
31개의 연구를 메타분석한 보고에 따르면 초음파의 액와부 림프절 전이에 대한 민감도는 61%, 특이도는 82%였고 액와부 림프절 전이 예측에 있어 초음파의 민감도와 양성예측도는 원발병소의 크기가 작을수록 낮아지는 경향을 보였다[16]. Hwang 등[17]의 연구에서는 종양의 크기가 2 cm 이하인 환자를 대상으로 하였고 액와부 림프절 전이에 대한 초음파의 민감도는 45.7%, 양성예측도는 59.7%로 보고하였으며, 민감도와 양성예측도가 낮아 액와부 림프절 청소술을 결정할 때 감시림프절 생검이 반드시 선행되어야 한다고 하였다. 본 연구에서 액와부 림프절 전이에 대한 초음파의 민감도는 65.8%, 특이도는 86.6%, 양성예측도는 70.4%로, 발표된 기존의 연구들과 비교하였을 때 민감도와 특이도, 양성예측도가 모두 높은 것으로 나타났다. 또한 종양의 크기가 2 cm 이하인 경우와 2 cm 초과인 경우로 나눠서 보았을 때 민감도(51.7% vs. 74.5%), 양성예측도(55.6% vs. 79.6%)인 것으로 나타났다. 전체적으로 봤을 때에도 민감도와 양성예측도가 낮았고 종양의 크기가 2 cm 초과인 경우만을 봤을 때에도 민감도와 양성예측도는 높아졌으나 위양성률 또한 높아, 유방암을 진단받은 환자에서 수술 전 액와부 림프절 전이 여부의 발견에 있어 감시림프절 생검 없이 단독으로 판단하기에는 불충분한 것으로 판단된다.
PET/CT는 유방암환자에서 원격전이, 재발여부, 항암화학치료의 반응을 평가하는 데 있어서는 유용하다고 알려져 있으나 국소림프절 전이여부를 평가하는 데 대한 유용성은 아직 정립되어 있지 않다. Liu [18]의 연구에서는 유방암에서 PET/CT를 통해 액와부 림프절 전이를 평가하는 연구를 고찰하였는데, 특이도(80%–100%)는 대체로 높았으나 민감도(22%–77%)는 낮은 경향을 보였다. Choi 등[2]은 PET/CT가 액와부 림프절 전이를 발견하는 데 민감도(37.3%), 특이도(95.8%), 정확도(75.3%)로 초음파(민감도 41.25%, 특이도 93.7%, 정확도 75.3%)에 비해 민감도가 낮아 초음파를 대체하기에 적합하지 않다고 보고하였다. Ueda 등[19]의 연구에서도 초음파(민감도 57.6%, 특이도 95.2%, 양성예측도 85%, 음성예측도 82%, 정확도 83.1%)와 PET/CT (민감도 54.2%, 특이도 85%, 양성예측도 97%, 음성예측도 82%, 정확도 84.7%)가 진단의 정확성은 거의 같으나 방사선 노출량과 비용 대비 효과를 고려하였을 때에는 초음파로 검사하는 것이 적합하겠지만, 초음파 단독으로 판단하기 어려운 경우에 있어서는 PET/CT가 진단에 큰 도움이 된다고 보고하였다.
본 연구에서 각각의 검사 중 초음파, CT, PET/CT의 결과를 비교하였을 때 PET/CT의 액와부 림프절 전이 여부에 대한 예측력은 초음파나 CT에 비해 떨어지지 않았음을 확인하였다(특이도 US 86.6%, CT 72.6%, PET/CT 86.0%, 양성예측도 US 70.4%, CT 56.1%, PET/CT 70.7%). 각각의 검사를 병합하여보았을 때에 초음파와 PET/CT를 조합하여 예측한 경우가 개별검사보다도 양성예측도가 10% 이상 상승하고, 다른 검사들의 조합보다도 특이도(93.6%)와 양성예측도(81.5%)가 높아 액와부 전이 여부에 대한 예측력이 가장 높은 것으로 나타났다. 또한 3가지 검사 모두에서 양성 소견이 보이는 경우를 양성이라고 판단한 경우와 비교하였을 때와도 거의 비슷한 결과를 보였다(특이도 93.6% vs. 94.3%, 양성예측도 81.5% vs. 82.7%). 그러므로 본 연구 결과에 의하면 액와부 림프절 전이상태를 평가하는 데 있어 초음파와 PET/CT 2가지를 병합하는 것이 초음파, CT, PET/CT 3가지를 모두 시행하는 경우에 준한 정확도를 보여주며, PET/CT가 수술 전 액와부 림프절 전이여부를 예측하는 데에 도움을 줄 수 있는 검사임을 시사한다.
현재 유방암 환자에서 액와부 림프절의 일반적인 병기설정 과정은 수술 전 임상적으로 액와림프절 전이가 없다고 판단되는 경우에는 감시림프절 생검을 통해 액와부 림프절 병기를 평가하며, 수술 전 임상적으로 액와림프절 전이가 있다고 여겨지는 경우에는 필요에 따라 초음파 유도 하 액와림프절 세침흡인검사나 중심침 생검을 통해 전이 여부를 확인한 후 액와림프절 청소술 시행 여부를 결정하거나 감시림프절 생검 없이 곧바로 액와림프절 청소술을 시행하는 것이다. 초음파와 PET/CT 결과 만으로 액와부 림프절 전이를 의심하여 감시림프절 생검 없이 액와부 림프절 청소술을 시행한다면 전체환자의 4.3% (10/233), 실제 액와부 림프절 전이가 없는 환자의 6.4% (10/157)는 과도한 액와림프절 청소술을 받을 가능성이 있다. 원발 종양의 크기에 따라나누었을 경우 2 cm 이하인 환자에서는 감시림프절 생검 없이 액와부 림프절 청소술을 시행한다면 전체환자의 2.9% (4/138), 실제 액와부 림프절 전이가 없는 환자의 3.7% (4/109)가 과도한 액와림프절 청소술을 받게 되며, 종양의 크기가 2 cm 초과한 경우에도 전체환자의 5.7% (6/105), 실제 액와부 림프절 전이가 없는 환자의 12.5% (6/48)에서 과도한 액와부 림프절 수술을 받게 된다. 그러므로 임상적으로 액와부 전이가 의심되는 경우라고 하더라도 수술 전 영상의학적 검사만으로 액와부 림프절 전이 상태를 파악하는 것보다는 일반적인 진료 가이드라인에 따라 필요하다면 감시림프절 생검을 시행하여 전이 여부를 판단하는 것이 이득이 있을 것으로 여겨진다.
한편 종양이 2 cm 보다 작은 경우에는 초음파, CT, PET/CT 세 가지 검사 모두에서 액와림프절 전이 음성이라면 실제 액와림프절에도 전이가 있을 확률이 10% 미만이므로, 감시림프절 생검술을 피할 수 있는 가능성도 있을 것으로 판단된다.
본 연구의 한계점으로, CT와 PET/CT 판독의가 초음파 결과를 이미 알고 판독하기 때문에 이것이 CT와 PET/CT 판독에 영향을 주었을 가능성이 있다. 하지만 CT와 PET/CT는 각 검사의 진단적 기준이 있으므로 초음파 결과가 CT와 PET/CT 판독에 명확하게 영향을 끼쳤을 가능성 또한 높지는 않았을 것이다. 또 하나의 한계점은 PET/CT의 비용효과적인 문제로써, 연구 대상인 환자들이 검사를 시행하였을 당시에는 한국 건강보험기준에서 유방암을 진단받은 환자에서 PET/CT를 시행하는 것이 급여 인정되었으나 현재는 유방암 환자에서 수술 전 병기설정을 위한 PET/CT가 일반적으로 보험 급여 인정이 되지 않기 때문에 초음파 시행 후 PET/CT가 액와부 림프절 전이상태를 파악하는 데 도움이 될 수 있다고 하더라도 검사하기 어려운 부분이 있다.
결론적으로, 유방암 환자의 수술 전 액와림프절 전이 여부 예측에 있어 PET/CT는 conventional method인 초음파나 CT와 비교하여 진단적 정확도가 뒤쳐지지 않았으며, 특히 종양 크기가 2 cm 보다 큰 경우에서는 초음파와 병합하였을 때 예측력이 더욱 높아져 PET/CT가 수술 전 액와림프절 전이 여부를 예측하기 위한 검사 방법으로써 가치가 있다고 여겨진다. 그러나 현재까지는 액와림프절 전이 여부의 판단에 있어 영상의학적 검사가 수술적 액와 병기 설정을 대체할 수는 없으며, 다만 종양의 크기가 2 cm 이하인 경우에서 모든 영상의학적 검사가 전이 음성이라면 선택적으로 감시림프절 생검의 생략을 고려해 볼 수 있겠다.
Notes
No potential conflict of interest relevant to this article was reported.