위암의 최소침습수술
Minimally invasive surgery in gastric cancer
Article information
Trans Abstract
Gastric cancer surgery with curative intent comprises subtotal or total gastrectomy with radical lymph node dissection. Recently, as the incidence of early gastric cancer (EGC) is increasing, minimally invasive surgery can be applied to gastric cancer treatment. Minimally invasive gastric surgery has four aspects such as minimally invasive access, modified function-preserving gastrectomy, limited lymphadenectomy, and no reconstruction. Laparoscopic gastrectomy became popular for EGC and its indication is being expanded to advanced gastric cancer. Reduced or single port gastrectomy can be performed for selective EGC. For middle or upper EGC, laparoscopic pylorus-preserving gastrectomy or proximal gastrectomy is applicable as function-preserving gastrectomy. D1+ node dissection is enough for EGC without lymph node metastasis and sentinel node biopsy will be helpful for avoiding unnecessary lymph node dissection in EGC patients.
서 론
위암은 우리나라에서 두 번째로 흔한 암이며 사망률도 폐암, 간암에 이어 세 번째로 높다[1]. 위암의 치료에 있어서 수술은 근치적 치료의 가장 중요한 방법이며 근치적 위암 수술은 광범위한 위 및 림프절 절제를 필요로 한다. 위암 수술은 1881년 Billroth가 처음으로 성공적으로 시행한 이후 위암 발생이 많은 한국, 일본을 중심으로 많은 발전이 있어 왔다. 20세기 후반에 복강경 수술 기법이 도입되면서 위암에서도 1991년에 복강경 위암 수술을 성공적으로 시행하게 되었다.
최근 국가암검진사업으로 위내시경이 활발하게 시행됨에 따라 조기 위암의 발견이 증가하였다. 따라서 복강경 위암 수술이 활발하게 시행되고 일부 조기 위암환자에게는 축소공 또는 단일공 수술도 가능하게 되었다. 또한 절제 범위도 축소되어 위를 보존하는 기능보존 위 절제술이 가능하게 되었는데, 중부 조기 위암에서는 유문보존 위 절제술이, 그리고 상부 조기 위암에서는 근위부 위 절제술이 시행되었다. 림프절 절제 범위도 기존의 D2 림프절 절제에서 조기 위암의 경우에 D1+ 절제로 축소되고 감시림프절 개념을 위암 수술에서도 적용하고자 하는 노력이 계속되고 있다.
이에 저자들은 현재 위암 치료에 시행되고 있는 최소침습수술의 최신 지견을 최소침습접근(minimally invasive access), 기능보존 위 절제(function-preserving gastrectomy), 축소 림프절 절제(limited lymph node dissection), 수술 후 조기 회복(enhanced recovery after surgery, ERAS) 프로그램 부분으로 나누어 문헌고찰과 저자들의 경험을 바탕으로 정리하고자 한다.
본 론
최소침습접근(Minimally invasive access)
복강경 위암 수술(Laparoscopic gastrectomy)
1991년 Kitano 등[2]이 조기 위암에서 복강경 위암 수술을 처음 시행한 이후로 조기 위암에서 복강경 위암수술은 해마다 증가해 왔으며 많은 발전이 있었다. 복강경 수술의 장점으로는 수술 후 통증, 염증 반응 및 합병증이 적고 회복이 빠르다고 할 수 있다[3]. 현재 조기 위암에서의 복강경 위암 수술의 효용성을 평가하기 위한 대규모의 다기관 전향적 무작위 비교 연구가 진행 중이다(Table 1). 한국에서 진행되고 있는 Korean Laparoscopic Gastrointestinal Surgery Study (KLASS) 01 연구는 2006년부터 2010년까지 등록된 1,416명의 cT1-2N0 위암 환자를 대상으로 복강경과 개복 원위부 위 절제술을 비교하는 연구로서 최종 결과인 5년 생존율이 2015년에 나올 예정이다[4]. 일본의 Japan Clinical Oncology Group (JCOG) 0912는 I기 위암 환자 920명을 대상으로 2010년부터 시작된 연구이다[5]. 이전에 보고된 작은 규모의 전향적 비교연구도 있었지만[6], 최근의 두 연구가 조기 위암에서의 복강경수술의 효용성을 입증해 줄 것으로 기대한다.
복강경 수술의 술기와 기구가 발전함에 따라 복강경 수술의 적응증을 진행위암까지 확대하고자 하는 노력이 진행되고 있다. Park 등[7]의 239명의 진행성 위암 환자를 대상으로 시행한 다기관 후향적 연구에 의하면 복강경 위암 수술 후 장기 생존결과는 개복 위암 수술의 결과와 비슷하였다. 현재 진행위암에서 진행되고 있는 3상 연구는 한국의 KLASS 02, 일본의 Japanese Laparoscopic Surgery Study Group (JLSSG) 0901, 중국의 Chinese Laparoscopic Gastrointestinal Surgery Study (CLASS) 01이 있다(Table 1). KLASS 02는 1,050명의 cT2-4a 위암 환자를 대상으로 복강경과 개복 위암 수술 후 3년 무재발 생존율을 평가하는 연구이며 이 결과는 향후 진행위암에서 복강경 수술의 적용을 확대하는 중요한 근거가 될 것이다[8].
다른 한편으로는, 절제 불가능한 4기 위암 환자에서 항암치료 후 절제 가능하게 전환되어 근치적 수술을 하는 전환 수술(conversion surgery)에서 복강경 위 수술을 시행하여 수술 후 적시에 항암치료가 이어지도록 도움을 주는 역할에 대한 연구도 이루어지고 있다.
축소공 및 단일공 위암 수술(Reduced or single port gastrectomy)
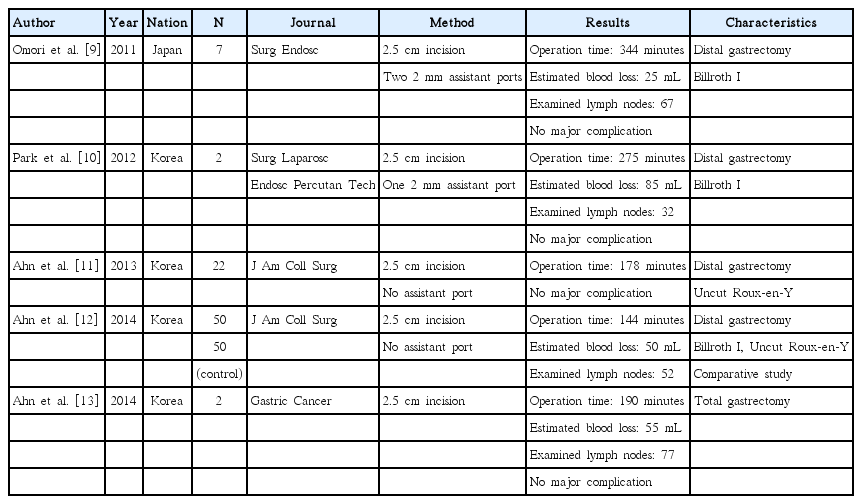
개복 위암 수술에서 복강경 위암 수술로의 발전이 있었고, 최근에는 자연 개구부를 통하여 복강 내로 접근하는 방법(natural orifice transluminal endoscopic surgery, NOTES)에 대하여 많은 전임상 및 임상 연구가 진행되고 있다[14]. 하지만 아직은 임상에 적용할 정도의 근거를 가지지는 못하고 있다. 그 중간 단계로 축소공(reduced port) 또는 단일공(single port) 수술이 활발하게 연구가 되고 있고 담낭 절제술, 충수돌기 절제술 등 양성 질환에 대하여 점차적으로 많이 시행되고 있다[15]. 하지만 아직 위암에서의 축소공 또는 단일공 수술은 아직 보고가 많지 않은데, 복강경 경험이 많은 몇 개의 기관에서 조기 위암에서의 단일공 수술을 보고하고 있다(Table 2) [9-12,16-19]. Ahn 등[12]에 의하면 단일공 수술을 받은 환자들이 기존의 복강경 수술을 받은 환자들에 비하여 미용적인 만족도가 높았고 출혈량과 수술 당일 및 익일의 수술 후 통증이 적었다고 보고를 하였다. 향후 단일공 위암 수술에 대한 연구가 연구회를 통하여 계속 활발하게 이어질 것으로 기대한다.
기능보존 위 절제(Function-preserving gastrectomy)
위암의 근치적인 수술로는 위 아전 절제와 위 전 절제만이 있었지만 최근 조기 위암의 증가로 인하여 위의 절제 범위도 줄어들게 되었다. 조기 위암에서는 약 2 cm 정도의 절제연을 확보하면 되기 때문에 위 아전 절제에서 원위부 위 절제술로 명칭도 바뀌었으며 조기 위암의 위치에 따라서 기능보존 위 절제술도 가능해졌다.
유문보존 위 절제술(Pylorus-preserving gastrectomy)
유문보존 위 절제술은 대표적인 기능보존 위 절제술 중의 하나로서 Maki 등[20]에 의하여 1967년 위 궤양의 수술적 치료 방법으로 소개되었다. 유문을 보존하기 위하여 1번, 5번, 12번 림프절 절제가 불가능하므로 위암에서는 그 림프절에 전이가 없다고 예상되는 중부 조기 위암에서 선택적으로 적용이 가능하다. 유문보존 위 절제술은 기존의 원위부 위 절제술에 비하여 유문을 보존함으로써 덤핑증후군과 담즙역류와 같은 위 절제 후에 생길 수 있는 여러 가지 소화기 증상을 줄여주고, 미주신경 간분지를 보존함으로써 담석의 발생을 줄여 준다는 장점이 있다[21,22]. 반면에 유문보존 위 절제술은 수술 후 위 배출 지연을 유발시킨다는 보고도 있다[23]. 하지만 이와 같은 보고들은 모두 후향적 연구이며, 따라서 유문보존 위 절제술에 대한 장점을 입증하기 위하여 현재 다기관 전향적 무작위 비교 연구인 KLASS 04가 진행 중이다. KLASS 04는 유문보존 위 절제술과 기존의 원위부 위 절제술 간에 일차 유효성 평가 변수인 수술 후 덤핑증후군 발생의 차이를 비교하고 이차적인 변수로서 영양, 삶의 질, 담석 발생률 등을 비교할 것이다.
근위부 위 절제술(Proximal gastrectomy)
상부에 생기는 위암의 경우 위 전 절제술이 표준 수술이었다. 최근 건강검진 위내시경의 시행으로 조기 위암이 증가하고 또한 서구와 같이 상부 위암이 증가하고 있다[24]. 상부에 생긴 조기 위암의 경우 원위부 위 주위의 림프절 전이는 드물기 때문에 근위부 위 절제술만으로도 위전절제술과 같은 장기 생존율을 가진다고 보고하고 있다[11,25,26]. 또한 근위부 위 절제술은 위 전절제술에 비하여 영양이 좋고 빈혈이 적으며 위장관 호르몬 분비 면에서 장점을 가진다고 알려져 있다[27,28]. 그런데 국내 전국조사에 의하면 근위부 위절제술은 2004년 1.1%, 2009년에 1.0%밖에 시행되지 않았다[24]. 근위부 위절제술이 여러 가지 이론적인 장점을 가지고 있음에도 불구하고 많이시행되지않는이유는후기합병증인위식도역류와그로인한 궤양 및 협착 때문이다[11,29]. 근위부 절제를 시행한 후 식도와 잔위를 바로 이어주는 식도-위 문합 후에 위식도 역류문제가 심각하기 때문에 많은 술자들이 식도-위 문합에 여러 가지 방법을 추가해 보았지만 일관되게 위식도 역류를 해결하지는 못하였다[29]. 따라서 식도와 잔위를 바로 이어주지 않고 소장을 삽입하여 식도-소장-잔위를 이어주는 문합을 비롯하여 식도-소장을 이어 준 후 잔위를 10–15 cm 하방에 이어주는 이중통로문합(double tract reconstruction)도 시행하게 되었다[30]. Ahn 등[30]은 근위부 위 절제술 후 이중통로문합을 하였을 때 위식도 역류증상이 위 전 절제술 하였을 때와 비슷하게 적었음을 보고하였다. 따라서 상부 조기 위암의 치료로서 근위부 위 절제술이 표준 치료로 인정받기 위해서 3상 비교 연구가 필요하게 되었고 현재 상부 조기 위암에서 복강경하 근위부 위 절제술 후 이중통로문합과 복강경 위 전 절제술을 비교하는 전향적 무작위 비교 연구인 KLASS 05 연구가 진행 중에 있다.
축소 림프절 절제(Limited lymphadenectomy)
위암의 근치적 수술에서 가장 중요한 요소는 광범위한 림프절 절제이다. 현재 진행위암에서는 16a2/b1에 전이가 의심되지 않는다면 예방적인 D2+ 대동맥주위 림프절 절제는 불필요하며 D2 림프절 절제가 표준 수술로 인정받고 있다[31]. 조기 위암에서는 D1+ 림프절 절제만으로도 근치적인 수술로 받아 들여지고 있다[32]. 조기 위암 중에 점막암인 경우에 림프절 전이율은 5% 이내이고 점막하암인 경우에는 15%–20%가 림프절 전이가 있다고 알려져 있다. 따라서 조기 위암일 경우 약 80% 이상에서 불필요한 광범위 위 절제 및 림프절 절제를 시행하고 있다. 조기 위암의 경우 절제연을 2 cm 이하로 하고 림프절 절제도 D1+ 정도로 축소되었지만 내시경점막하 절제술에 비하면 여전히 광범위 위 절제 및 림프절 절제라고 볼 수 있다. 만일 조기 위암 환자에서 림프절 전이 여부를 정확하게 알 수 있다면 불필요한 광범위 절제를 피할 수 있겠지만, 현재 수술 전 시행하고 있는 위내시경 또는 위내시경초음파, CT 검사로는 림프절 전이 여부를 100% 정확하게 알지 못하기 때문에 광범위 절제가 불가피한 현실이다. 감시림프절이란 원발암으로부터 림프절 전이가 일어나는 첫 번째 림프절을 의미한다. 따라서 감시림프절의 전이 여부를 조사하여 전이가 없다면 다른 두 번째 세 번째, 그 이후의 림프절에도 전이가 없기 때문에 불필요한 림프절 곽청을 피할 수가 있다. 현재 유방암과 악성 흑색종에서는 활발하게 감시림프절 생검이 이루어지고 있고 많은 환자들이 불필요한 림프절 곽청을 생략함으로써 림프부종, 감각이상, 운동 장애 등의 합병증을 피할 수 있게 되었다. 위암은 유방암과 악성 흑색종과 달리 림프절 경로가 복잡하여 감시림프절 생검의 적용이 어렵다고 생각하였으나 많은 연구에서 긍정적인 결과들이 나오게 되었다[33-37]. 현재 진행되고 있는 2상 또는 3상 연구는 Table 3과 같으며 이들의 결과에 따라 조기 위암에서 감시림프절 생검의 적용이 표준 술식으로 자리잡을 수 있는 계기를 마련하게 될 것이다.
수술 후 조기 회복(Enhanced or early recovery after surgery)
수술 후 조기 회복 프로그램은 여러 외과 수술 분야, 특히 대장항문 수술에서 수술 후 회복을 향상시키기 위하여 연구가 많이 되었지만 아직 위암 수술 분야에는 보고가 적다. 몇 저자들의 보고에 의하면 위암 수술 후에도 enhanced or early recovery after surgery (ERAS) 프로그램 적용이 가능하며 국소적인 합병증이 적었다고 하였다[38,39]. 최근 97명의 복강경 위암 수술을 받은 환자들을 대상으로 ERAS군(n = 46)과 그렇지 않은 군(n = 51)으로 무작위 배정을 하여 비교하였을 때 ERAS군에서 수술 후 회복률과 시간이 더 빨랐고 통증이 적었다는 좋은 결과가 미국복강경학회에서 발표되었다[40].
결 론
위암의 치료에서 최소침습수술은 접근 방법, 위 절제, 림프절 절제 범위면에서 다양하게 적용이 되고 있다. 접근 방법 면에서는 복강경 위암 수술의 많은 발전이 있었으며 조기 위암뿐만이 아니라 진행위암으로도 복강경 위암 수술의 적응증이 확대되고 있다. 특히 조기 위암의 경우에는 축소공 또는 단일공 수술을 선택적으로 적용할 수 있다. 위 절제 범위에서는 중부 조기 위암에서 유문보존 위 절제술을, 상부 조기 위암에서는 근위부 위 절제술을 시행할 수 있겠다. 림프절 절제 범위에서는 조기 위암의 경우 D1+ 림프절 절제가 가능하며, 가까운 미래에 감시림프절 생검의 3상 시험이 긍정적인 결과가 나오면 감시림프절 전이가 없는 조기 위암은 국소 위 절제만으로도 근치적인 치료가 될 것이다. 또한 수술 후 조기 회복 프로그램으로 위암 수술 후 환자의 회복률을 향상시킬 수 있을 것으로 기대한다.
Notes
No potential conflict of interest relevant to this article was reported.