성장인자를 제외 한 배양액에서의 간암세포주의 구체 형성 배양
Sphere-forming cultivation of liver cancer cell line in culture media without growth factors
Article information
Trans Abstract
Purpose:
Cancer stem cells have the characteristics similar to the normal stem cell but are cancer cells. Sphere forming culture has been adapted as a culture method for cancer stem cells. In this study, we validated to optimal culture condition for sphere formation of hepatocellular carcinoma cell line using three different types of culture media.
Methods:
Huh7 cells were plated in different culture media allowed for sphere formation. M1, Dulbecco’s Modified Eagle’s medium (DMEM)-high glucose with fetal bovine serum (FBS); M2, DMEM-high glucose without FBS; and M3, DMEM-F12 (Gibco, Grand Island, NY, USA) with B27, epidermal growth factor, basic fibroblast growth factor (bFGF, Invitrogen, Seoul, Korea). Sphere formation was observed by light microscope. Proliferation of the sphere-forming cells was evaluated by Cell counting kit-8 (CCK-8) analysis.
Results:
Cells in M1 and M3 media were formed sphere. Sphere-forming cells in M1 and M3 were bigger than M2 cells and had similar morphology. Sphere-forming cells in M3 media showed higher level of cell proliferation than M1 and M2 cells on 15 days, while sphere-forming cell in M1 media were exhibited higher level than others on post 20 days. Proliferation of M2 cells did not improve.
Conclusion:
Results showed that sphere-forming cells in M1 and M3 media had similar character. So, it is assumed that a growth factor-free medium is adaptable or efficient tool for in vitro cultivation of cancer stem cells, because the tool shall be reduced expense for experiments without the adding of growth factors.
서 론
간암(hepatocellular carcinoma)은 세계에서 다섯 번째로 흔한 암이며 세 번째로 사망률이 높은 암이다[1]. 외과적 절제가 간암치료의 가장 근치적인 치료방법이지만 발견 당시 병이 진행되어 색전술, 방사선 치료 등을 시행하기도 한다. 하지만 치료 후에도 다시 재발(recurrence)하거나 타 조직으로의 전이(metastasis)가 일어나게 되어 악화되는 경우가 적지 않다. 최근 암 줄기세포(cancer stem cell) 이론이 크게 주목되어 암의 재발과 전이는 암 줄기세포에 의해 생기는 것으로 설명되고 있다. 암 줄기세포는 암 조직에서 1%–2% 미만으로 존재하며 항암제에 대한 내성을 갖고 있어 치료 시 죽지 않고 잠재되어 있다가 다시 암세포로 분화되어 혈관을 통하여 다른 조직으로의 전이 및 무한증식이 가능하다고 알려져 있다[2]. 암 줄기세포는 줄기세포에서 발현하는 표지자(surface marker) (CD133, CD44, CD90 등)가 동일하게 발현되기도하며 자가 증식을 한다는 점과 다른 세포로 분화할 수 있다는 점에서 줄기세포와 비슷하다. 하지만 암 줄기세포에 대한 확실한 신호체계(signal pathway)와 암 줄기세포에서만 발현되는 특이 표지자가 발견되지 않았기 때문에 암 조직에서 암 줄기세포만을 정확히 분리하는 방법은 아직 확립되지 않았다. 암환자에게 얻은 암 조직에서 암 줄기세포를 분리하여 체외 배양을 통하여 많은 양의 암 줄기세포를 확보할 수 있다면 이 세포를 목표로 하는 환자 개개인별 맞춤 치료를 확립할 수 있기 때문에 암 줄기세포의 특성을 확인하는 연구가 중요하며 이러한 시도가 계속 되고 있다[3]. 암세포의 배양 시 많이 사용되는 구체형성 배양법은 세포 배양접시에 부착하여 배양하는 방법과 달리 특수 배양접시에 부유 상태로 세포를 키우는 방법이다. 일반세포는 부착되지 않은 상태에서 배양 시 아노이키스(anoikis)라는 세포죽음이 일어나게 되는데 반해 암세포는 이와 다르게 부착되지 않은 상태에서 세포끼리의 활성화를 통하여 구체를 형성하며 자라게 되는 것이다[4,5]. 실제로 구체형성 배양을 통해 성장한 암세포를 마우스에 이식하였을 때 단층 배양을 통해 성장한 암세포에 비해 적은 세포 수에도 불구하고 암 형성이 잘 되었으며, 형성된 암의 크기 또한 더 큰 것이 관찰되었다[6]. 이러한 구체형성 배양 시 환경적 요인이 중요하다. 세포가 바닥에 부착되지 않도록 특수 코팅이 된 배양접시를 사용하게 되며 배양액에 여러 가지 성장인자를 첨가하게 된다. 혈청이 없는 배양액(serum-free media)을 기본으로 상피세포 증식인자(epidermal growth factor, EGF), 섬유아세포성장인자(basic fibroblast growth factor, bFGF), b27 보충제(supplement)의 여러 가지 성장인자가 첨가된다. 첨가되는 성장인자들의 농도는 세포 종류에 따라 조금씩 다르며, 각각의 성장인자가 세포에 미치는 영향 또한 다르다. 상피세포 성장인자(EGF)에 의한 신호전달(signaling)은 상피세포 성장인자 수용체(EGF receptor)을 통하여 활성화(activation)되며, 신경교종줄기세포에서 줄기세포 성(stemness)을 유지하는 데 중요한 역할을 한다고 알려져 있다[7]. 이러한 성장인자는 세포의 성장과 증식을 촉진하지만 세포의 분화 역시 촉진할 수 있으므로 사용 시 각별한 주의가 요구된다. 앞에서 언급한 바와 같이 암 줄기세포 역시 분화할 수 있는 특징을 갖고 있기 때문에 성장인자에 의한 분화도가 증가할 수 있다고 생각한다. 그러므로 본 연구자는 암 줄기세포의 구체형성 배양 시 성장인자를 첨가하지 않고 기존의 암세포 배양액에서 구체 형성이 가능한지 연구해 보고자 하였다.
방 법
세포배양(Cell culture)
단층배양(Monolayer culture)
간암세포주인 Huh7 세포주(cell line)를 일반 배양 접시(culture plate)에 1×104 cells/cm2의 밀도로(10% 소 태아혈청[fetal bovine serum, FBS]과 1×Antiniotic-Antimycotics가 첨가된 Dulbecco’s Modified Eagle’s medium (DMEM)-high glucose (Gibco, Grand Island, NY, USA)배양액에 분주한다.
구체형성배양(Sphere-forming culture)
융합(confluence) 정도가 80%가 되면 1× Trypsin-EDTA를 사용하여 세포를 뗀 후 24 well ultra-low attachment plate (corning costar, NY, USA)에 1×104 cells/mL의 밀도로 임의로 명명한 세 종류의 배양액 M1 (DMEM-High glucose with 10% FBS, 1×Antiniotic-Antimycotic (Gibco, Grand Island, NY, USA), M2 (DMEM-high glucose without FBS, 1×Antiniotic-Antimycotic [Gibco]), M3 (DMEM/F12 with 1×supplement b27, 20 ng/mL epidermal growth factor [EGF]), basic fibroblast growth factor (bFGF, Invitrogen, Seoul, Korea), 1X Antiniotic-Antimycotic (Gibco)에서 구체 형성 배양한다.
세포 형태 관찰(Cell morphology)
구체형성배양(sphere-forming culture) 후 각각 배양액 군별로 0, 1, 3, 5, 7, 15, 20일 후 도립 현미경(inverted microscope)으로 세포의 형태를 관찰한다.
세포의 분화 속도(Cell proliferation)
구체 형성 배양(sphere-forming culture) 후 각 배양액 별로 1, 3, 5, 7, 15, 20일째 증식 속도를 Cell counting kit-8 (Dojindo Laboratories, Kumamoto, Japan)을 이용하여 흡광도 450 nm에서 효소결합 면역흡착측정법(enzyme-linked immunosorbent assay) 판독기(reader)로 측정한다.
결 과
각각의 세포 배양액에서의 간암 세포 주 구성 형성 배양(Fig. 1)
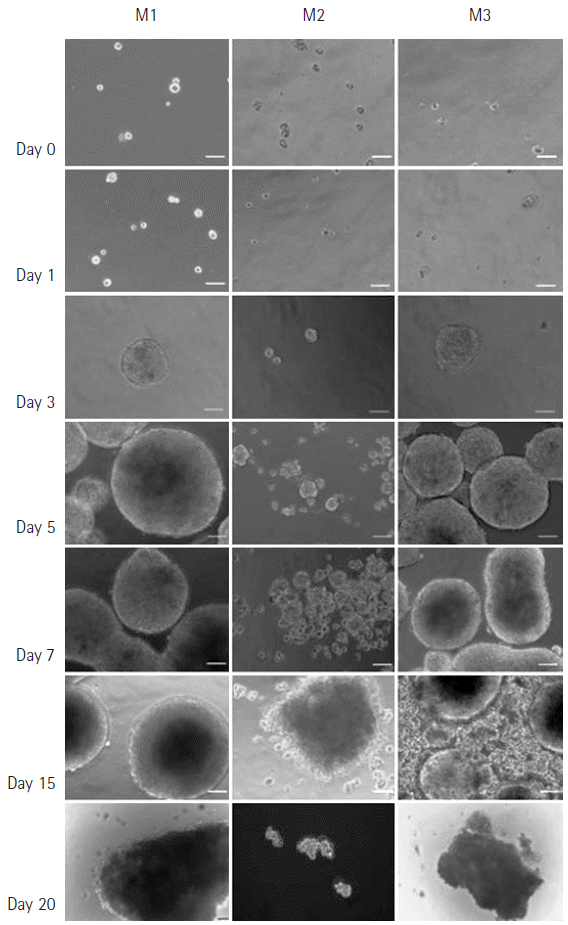
Sphere forming cells: the photomicrograph shows human Huh7 cells grown in non-adherent sphere forming culture on 0, 1, 3, 5, 7, 15, and 20 days. Each sphere forming cells are approximately 100–200 μm in diameter (×200). M1, media 1; M2, media 2; M3, media 3.
M1 배양액
배양 후 1일까지 단일세포의 형태로 부유하는 것을 관찰할 수 있었으나 3일 후부터 구체(sphere)의 형태로 크기가 커지는 것을 볼 수 있었다. 5일 후부터 구체(sphere)의 크기가 300 µm 이상 커졌으며, 그 이후 구체(sphere)들이 서로 부착되는 특징을 보였다. 15일째 더 이상 커지지 않았으며, 20일 이후에는 구체의 형태가 변화하며 세포가 떨어져 나가는 것을 관찰할 수 있었다.
M2 배양액
다른 배양액과 비교 시 구체(sphere)를 형성하지 못하고 세포가 죽는 것을 관찰할 수 있었다.
M3 배양액
배양 후 3일부터 구체(sphere)를 형성하기 시작하였으며, 5일부터 크기가 커지는 것을 관찰할 수 있었다. 하지만 15일 이후부터 구체(sphere)의 형태가 변하기 시작하였으며, 세포들이 떨어져 나가는 것을 볼 수 있었다. 20일 이후부터는 구체의 형태를 찾아보기 힘들었다.
각각의 세포배양액에서의 간암 세포주 생장 속도(Fig. 2)
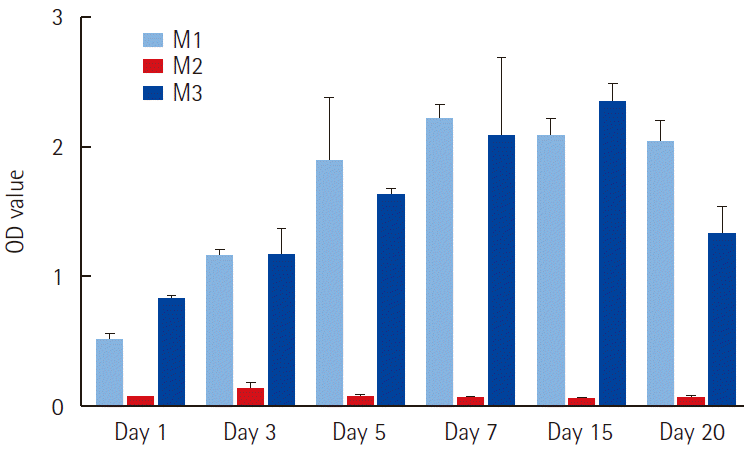
Proliferation analysis of sphere-forming cells. OD, optical density; M1, media 1; M2, media 2; M3, media 3.
구체 형성 세포(sphere forming cells)의 자가 증식 정도를 비교한 결과 배양 후 M1, M3 배양액의 세포는 15일까지 점차적으로 증가하는 추세였으며, M2 배양액의 세포는 증식하지 않은 것을 관찰할 수 있었다. M1과 M3의 세포군을 비교한 결과 M1의 세포군은 7일부터 20일까지 감소하기는 하였으나 거의 차이를 보이지 않았던 반면, M3의 세포군은 15일 이후 급격하게 감소하였다.
결과로 보아 성장인자가 배양 초기에는 세포 성장에 촉매 역할을 하지만 배양 기간이 오래되면 성장인자의 유무가 세포의 성장에 관여하지 않는 것으로 보인다.
고 찰
암 줄기세포(cancer stem cells)는 2006년 American Association for Cancer Research Workshop on Cancer Stem Cells에서 명명 되었으며, 이 세포는 암 조직 안에 포함된 것으로서 자가증식 능력과 암세포로의 분화가 일어나는 세포로 정의되었다[8]. 처음 급성 골수 백혈병(myeloid leukemia)에 존재 한다고 Bonnet와 Dick [9]에 의해 밝혀졌으며, Al-Hajj 등[10]은 최초로 뇌, 유방, 폐, 전립선 등의 고형조직 암 등에 존재함을 입증하였다. 암 조직은 여러 가지 세포로 구성되어 있는 조직(heterogeneous tissue)으로서 암 줄기세포만을 분리하는 방법에는 여러 가지가 있는데 그 중 암 줄기세포의 체외 배양 방법 으로 사용되는 구체 형성 배양법은 세포 배양 접시(cell culture plate)에 부착되지 않은 상태로 배양되는 방법으로서 신경, 전립선(prostate), 유방(mammary) 등의 성체 줄기세포(adult stem cell)에서 사용되어 왔다[11,12]. 이러한 구체 형성 배양 시 사용되는 배양액은 혈청(serum)을 첨가하지 않고 성장인자(예를 들어, EGF, bFGF)를 첨가하여 증식시킨다고 알려져 있다[6,13]. 하지만 유방암세포주와 폐암세포주에서는 이러한 성장인자가 없는 배양액에서 오히려 내피성장인자가 자가 분비(autocrine)되어 암 줄기세포의 구성 형성의 성장을 촉진시키고 증가된다는 연구 결과가 있다[13].
간암에 존재하는 간암줄기세포 역시 앞의 이론을 바탕으로 구체 형성 배양 시 배양액을 다르게 하였을 때 구체 형성이 되는지 알아보고자 하였다. 그 결과 성장인자의 유무와 관계 없이 구체 형성이 모두 잘 되었으며 비슷한 크기로 자라는 것을 관찰할 수 있었다. 하지만 혈청과 성장인자 모두 첨가하지 않은 배양액에서는 구체 형성이 되지 않았으며, 세포가 죽는 것으로 보아 세포가 자라기 위해서는 최소한 조건이 충족되어야 하는 것을 알 수 있었다. 배양기간이 길어질수록 각 배양액의 세포 군은 다른 양상을 보였는데 혈청이 첨가된 배양액의 세포는 구체 형성이 유지되며 크기가 커졌으나 성장인자가 첨가된 배양액의 세포 군은 처음과 다르게 구체의 형태를 소실하였고 죽은 세포들이 보이기 시작하였다. 성장인자의 첨가 유무는 구체 형성에 크게 영향을 끼치지 않지만 배양기간이 길어지게 되면 성장인자들이 첨가된 배양액에서는 세포에 영향을 끼치는 것으로 생각된다. 또한 각 성장률을 비교하였을 때 성장인자가 배양 초기에는 세포성장에 영향을 끼치지만 배양 기간이 길어지면 크게 영향을 끼치지 않는 것으로 보이며 오히려 성장인자를 첨가하지 않은 배양액의 구체 형성 세포(sphere forming cells)들이 구체(sphere)의 유지가 더 잘 되는 것으로 보였다. 더 나아가 특징적으로도 큰 차이가 없는지 비교하고 각 군의 세포에서 발현되는 유전자와 표지자들의 비교 분석을 위하여 array 분석 등의 실험이 추가 되어야 할 것이며 각 배양액의 구체 형성 암 줄기세포의 계대 배양을 통하여 특성이 변화 되는지의 여부 관찰이 필요할 것으로 생각된다. 암 줄기세포를 체외 배양 시 성장속도와 형태학적 특징이 성장인자를 넣어주지 않은 것과 큰 차이가 없다면 세포의 증식과 유지에 있어서 비용이 6배 이상 감소될 것으로 예상한다. 그리고 암 줄기세포가 암 세포로의 분화가 가능한가를 입증하기 위하여 각 군의 구체 형성 배양 세포를 동물 모델의 이식을 통하여 종양 형성 여부를 확인하는 실험이 필요할 것으로 생각된다.
Notes
No potential conflict of interest relevant to this article was reported.