4기 위암에서 수술적 치료의 역할
The role of surgery in stage IV gastric cancer
Article information
Trans Abstract
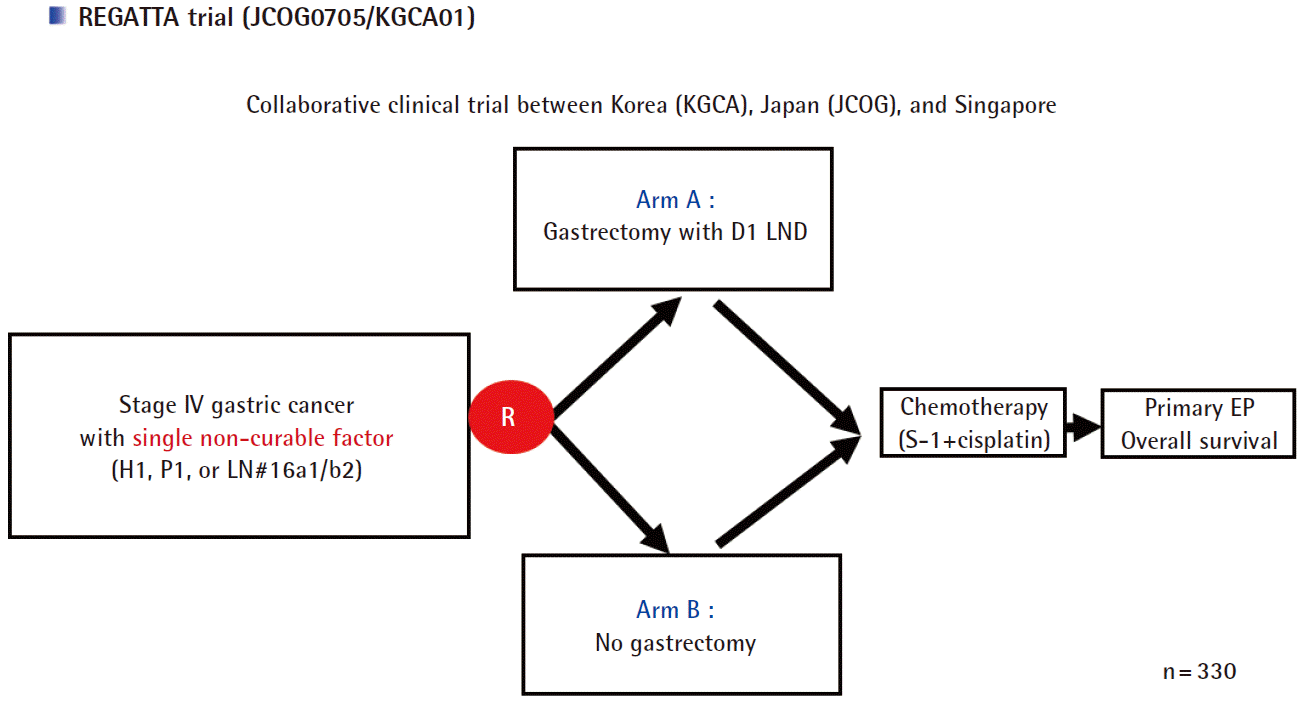
Surgery plays a key role in gastric cancer treatment without distant metastasis. However, once distant sites are involved, no optimal therapeutic strategy has been established. Because M1 gastric cancer is a heterogeneous disease entity according to the extent and site of metastasis, it is difficult to analyze and interpret the result of study subjected to relative small number of patients. In patients without symptoms, several studies have shown that reductive surgery might have a benefit in terms of survival and quality of life. A randomized controlled trial of reduction surgery plus chemotherapy versus chemotherapy alone for M1 gastric cancer is ongoing (REductive Gastrectomy for Advanced Tumor in Three Asian countries [REGATTA], JCOG0705/KGCA01), and the result would be reported in near future. Currently, as an initial treatment for M1 gastric cancer, chemotherapy is generally used in order to reduce tumor-related symptom and prolong survival. For patients responsive to chemotherapy, some retrospective studies reported that longer survival was observed in resection group after disappearing of distant metastasis. Recently, Japanese group reported that a multimodality treatment consisting of chemotherapy with S-1 and cisplatin followed by gastrectomy with D2+ para-aortic lymph node dissection was found to be promising for metastasis to the 16a1/b2 para-aortic lymph nodes.
서 론
위암은 세계에서 5번째로 발생 빈도가 높은 암이며 3번째로 사망률이 높은 암이다[1]. 한국에서는 현재 갑상선암에 이어 2번째로 발생 빈도가 높은 암이며, 국가 조기 건강 검진에 효과로 조기위암의 빈도가 점점 늘어나고 있으나, 진단 시 원격 전이를 동반한 경우도 6.3%–9.0%에 이른다[2,3]. D1+ 또는 D2 구역 림프절 절제를 포함한 근치적 절제가 위암 치료의 근간을 이루나, 원격 전이를 동반한 M1 위암의 경우 아직 원칙적인 치료 방침이 정해져 있지 않은 상태이다.
일반적으로 M1 위암의 일차 치료로, 암으로 인한 증상 완화 및 생존 연장을 목적으로 항암화학 요법을 시행하는데, 1990년대 5-FU 단일 요법과 5-FU를 기본으로 하는 병합요법에 대한 비교 연구가 시행되었으며, 5-FU+cisplatin 병합 군에서 7.2–8.5개월의 중앙 생존기간이 관찰되었다[4,5]. 이후 5-FU, cisplatin에 Docetaxel을 추가한 연구에서 9.2개월의 중앙 생존기간이[6], JCOG9912 연구에서는 S-1 단일 요법으로 11.4개월의 중앙 생존기간이 관찰 되었다[7]. 최근 전통적인 항암제에 단클론 항체를 추가한 표적 치료로 중앙 생존기간은 13.8개월로 연장되었다[8].
원격 전이를 동반하지 않은 위암에서, 병기를 낮추고, 근치적 절제를 가능하게 하기 위해서 선행화학요법(neoadjuvant chemotherapy)를 시행하기도 하며, 선행 화학 요법 후 근치적 절제를 시행할 경우 생존율의 향상 된다는 보고가 있다[9,10]. 하지만 M1 위암에서는 수술이 생존율을 향상시킬 수 있는지에 대한 연구가 매우 한정적이다. M1 위암의 치료는 NCCN 가이드라인에서는, 항암화학요법, 임상연구, 또는 최선의 지지치료(best supportive care)이며, 일본위암학회의 치료 가이드라인에서는, 항암화학요법, 방사선치료, 고식적 수술 또는 의료행위로 제시하고 있다[11,12].
M1 위암이 출혈 및 폐색을 동반한 경우 증상 완화를 목적으로, 내시경적 시술, 방사선 중재시술 또는 고식적 수술을 시행하게 되는데, 고식적 수술에 대해 이번 종설에서는 논외로 하기로 한다. 이번 종설에서는 M1 위암 환자에서 생존율 향상을 위해 수술적 치료가 어떠한 역할을 할 수 있는지에 대해 문헌 고찰을 통해 알아보고자 한다.
본 론
Reduction surgery
출혈 또는 폐색의 증상이 없는 M1 위암에서, 항암치료 전에 암종의 부피를 줄여 생존율 향상을 도모하려는 수술을 reduction surgery라고 한다. 많은 후향적 연구가 reduction surgery을 시행하는 것이 생존율 및 삶의 질을 향상시키고, 증상을 완화시킨다고 보고하고 있다[13-15]. Hartgrink 등[16]은, 70세 미만의 환자에서 전이가 한 곳에 국한되어 있을 경우, reduction surgery 시행 군이 항암화학요법만 시행한 군에 비해 긴 중앙 생존기간(10.5개월 vs. 6.7개월, P=0.034)을 보인다고 보고하였다. Chang 등[17]은, 전이가 한 곳에 국한되어 있을 경우, reduction surgery 시행 후 항암화학요법을 시행한 군에서 긴 중앙 생존기간(14.0개월 vs. 9.7개월, P=0.040)을 보였으며, 두 곳 이상에 전이가 진행되었을 경우 중앙 생존기간(10.2개월 vs. 11.2개월, P=0.400)에 차이가 없다고 보고하였다. 많은 연구에서 reduction surgery 후 항암화학요법을 시행한 군이 항암화학요법만 시행한 군에 비해 생존율 향상이 관찰되고 있으나 선택 비뚤림(selection bias)이 작용할 여지가 많다.
최근 한 개의 비치유 인자(간전이, 복막전이, 16a1/b2 대동맥림프절전이)를 가진 M1 위암에서 reduction surgery 후 생존율이 향상되는지 알아보고자 하는 REductive Gastrectomy for Advanced Tumor in Three Asian countries (REGATTA) 연구(JCOG0705/KGCA01)가 시행되었다(Fig. 1) [18]. 아직 최종 결과는 나오지 않은 상태이며 reduction surgery의 효용에 대해 명확한 결론을 내려줄 연구라 생각된다.
Conversion surgery
Conversion surgery는 M1 위암에서 항암화학요법 시행중, 전이암의 관해가 나타난 후 완전 절제를 목적으로 위절제를 시행하는 것을 의미한다. Conversion surgery를 시행하기 위해서는 전이암이 항암화학요법에 의해 완전 관해가 되었다는 전제가 필요하며, 따라서 초기에 발견되었던 모든 암 병소를 절제하는 것은 아니다.
Han 등[19]은 항암화학요법 후 전이암의 관해를 보여 완치목적(curative intent)로 수술을 시행한 34예를 대상으로 한 연구를 보고하였다. 76.5%에서 R0 절제가 가능하였으나 R0 절제 후 61.5%에의 재발률을 보였으며, 추적관찰기간 동안 38.5%의 환자가 무병상태였다. 특히 무병상태인 환자의 90%는 항암화학요법 전 전이가 한 곳에 국한되어 있던 환자들이었다. Kitayama 등[20]은 64명의 복막전이 위암에 대해 S1, paclitaxel 항암화학요법 및 복강내 paclitaxel 투여를 시행하였고, 34명의 환자에서 복막전이의 관해를 보여 위절제를 시행하였다. 위절제를 시행한 군은 중앙 생존기간 26.4개월로 시행하지 않은 군의 12.1개월에 비해 유의한 차이를 보였다. Fukuchi 등[21]은 S1+cisplatin 또는 paclitaxel 항암요법후 conversion surgery를 시행한 40예를 분석하였으며, 위절제를 시행한 군에서 긴 중앙 생존기간(53개월 vs. 14개월, P<0.01)을 보였다. Wang 등[22]은 16a2/b1 대동맥 림프절 전이가 있는 48명의 환자를 대상으로 XELOX 요법 후 대동맥 림프절의 관해가 나타난 28명의 환자에서 D2 위절제를 시행하였으며 수술군에서의 높은 생존율의 보고하였다.
M1 위암에서 항암화학요법 시행 후 전이암의 관해가 나타난 후 conversion surgery를 시행할 경우 생존기간을 연장할 수 있음이 여러 후향적 연구에서 보고되었으며, 특히 전이암이 한 곳에 국한되어 있는 경우 더 좋은 예후를 보였다. 하지만 전이암의 관해가 이루어진 상태에서 항암화학요법을 지속하는 것과 conversion surgery를 시행하는 것에 대한 비교연구는 없는 상태이며, 향후 이 부분에 대한 연구가 필요하다고 생각된다.
D2+대동맥림프절 절제
Conversion surgery와는 다르게 D2+대동맥림프절 절제는 항암화학 요법이 암세포의 미소전이(micrometastasis)는 줄일 수 있어도 전이암 자체(gross tumor)는 치유하지 못함을, 그리고 16a2/b1 대동맥 림프절이 절제 가능하다는 것을 전제로 한다. 대동맥림프절 전이가 있는 경우, 여러 Japanese Clinical Oncology Group (JCOG) 연구가 항암 치료 후에, D2+대동맥림프절을 동반한 위절제에 대해 보고하였다. 이들은 bulky N2/N3 림프절 전이가 있는 위암을 대상으로 한 2상 연구이며, bulky N2/N3의 정의는 다음 중 하나에 해당하는 경우이다: (1) 3 cm 이상 크기의 한 개 이상의 림프절(No. 7, 8, 9, 11), (2) 1 cm 이상 크기의 인접한 3개 이상의 림프절(No. 7, 8, 9, 11), (3) 1 cm 이상 크기의 대동맥림프절(No. 16a2/b1) [23]. JCOG0001 연구는 bulky N2/N3 위암을 대상으로 irinotecan과 cisplatin을 사용하였으며, R0 절제율은 65%였고 3년 생존율은 15% 였다[24]. JCOG0405 연구는 S1+-cisplatin 항암화학요법을 사용하였으며, 82%의 R0 절제율 및 59%의 3년 생존율을 보였다[25]. 또한 bulky N2/N3 위암을 대상으로 S1+-cisplatin+docetaxel 항암화학요법 후 D2+대동맥림프절 절제를 시행하는 JCOG1002 연구가 진행 중에 있다[26].
비록 수가 한정되어 있고 선택 비뚤림이 작용할 여지가 있지만, 항암화학요법에 이은 D2+대동맥림프절 절제로 생존율을 향상시킬 수 있음이 여러 2상 연구에서 보고되고 있다. 현재 다른 원격전이가 없는 16a2/b1 대동맥 림프절 전이는 경계성 절제가능 암(borderline resectable cancer)로 간주할 수 있으며, 치료방침에 따라 conversion surgery 또는 D2+대동맥림프절 절제를 시행해볼 수 있겠다[27].
간전이의 수술적 절제
위암의 간전이는 일반적으로 간의 양측을 침범하는 다발성 전이로 나타나고 간 외 전이를 동반하는 경우가 많기 때문에 수술의 적응증이 되는 경우가 극히 드물다. 한정된 환자수로 인해 임상 연구가 진행되기 힘들며 지금까지 소수의 환자를 대상으로 한 후향적 연구가 대부분이다. 5년 생존율은 0%–37%이며, 선택된 환자군에서 장기 생존자가 관찰되기도 한다. 1개의 간전이(solitary metastatic nodule)가 가장 흔히 언급되는 예후 인자이며 수술 후 간내 혹은 간외 재발이 흔히 나타나기 때문에 항암화학요법이 필수적이다[28-30].
결 론
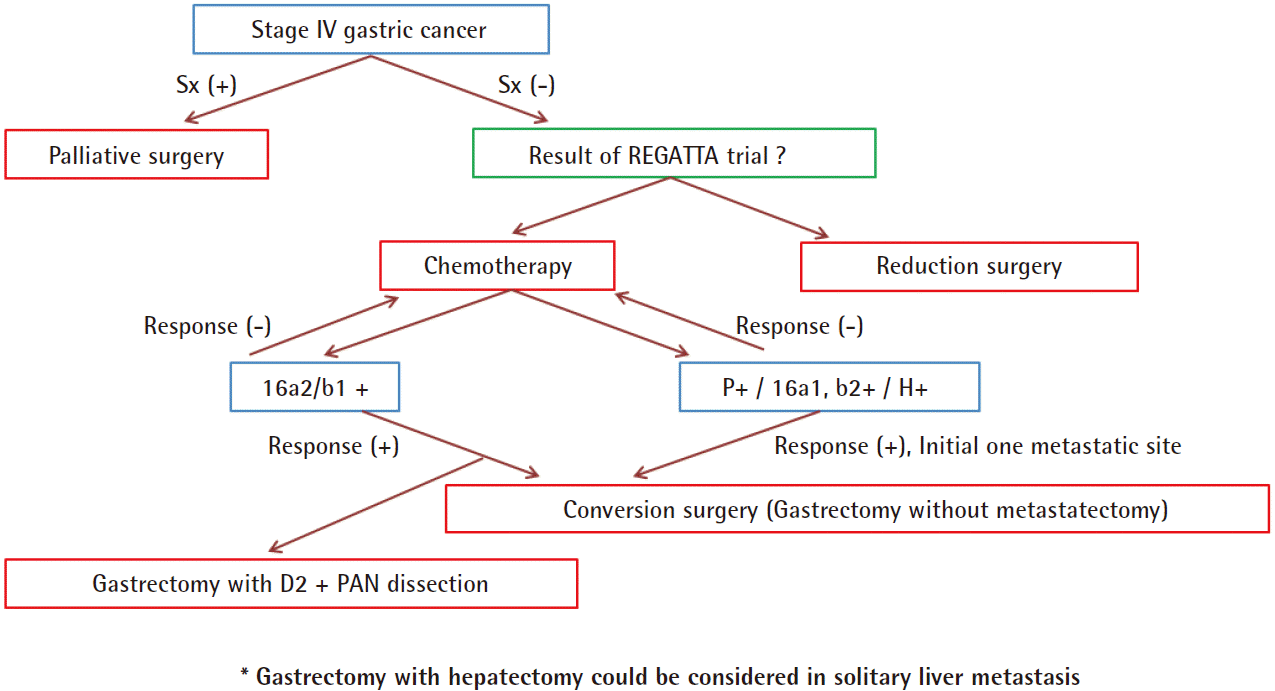
지금까지의 문헌 고찰을 정리해 보면, 증상을 동반하지 않은 M1 위암의 1차 치료는 항암화학요법이며 향후 발표될 REGATTA 연구의 결과에 따라 reduction surgery를 고려해 볼 수 있다. 일차적으로 원격 전이 병소의 위치가 한 곳에 국한되었을 때, 원격 전이 병소의 관해가 나타난 경우 conversion surgery를 시행할 수 있으며, 대동맥 림프절 16a2/b1에서 관해가 나타난 경우 D2림프절 및 대동맥 림프절 절제를 포함한 위절제를 시행할 수 있다. 또한 1개의 간전이를 동반한 위암의 경우, 간절제를 동반한 위절제를 시행할 수 있다(Fig. 2). M1 위암에서의 수술의 역할은 대부분 소규모의 환자를 대상으로 한 후향적 연구로 보고되고 있다. 따라서 향후 각 주제별로 REGATTA 연구와 같은 대규모의 다기관 공동 연구가 필수적이라 생각된다.
Notes
No potential conflict of interest relevant to this article was reported.