절제불가능 혹은 전이성 위암환자들에게 일차 화학요법으로 시행한 TS-1/Cisplatin 병합요법의 결과
The results of primary chemotherapy of TS-1/cisplatin regimen in unresectable or metastatic gastric cancer patients
Article information
Trans Abstract
Purpose:
This study was conducted to evaluate the response rate, side effect and resection rate after primary chemotherapy of TS-1/cisplatin regimen in unresectable or metastatic gastric cancer patients.
Methods:
From January 2005 to December 2012, 44 patients with unresectable or metastatic gastric cancer were enrolled onto the study. The regimen of primary chemotherapy was TS-1/cisplatin.
Results:
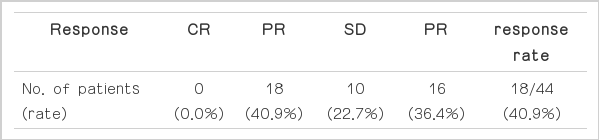
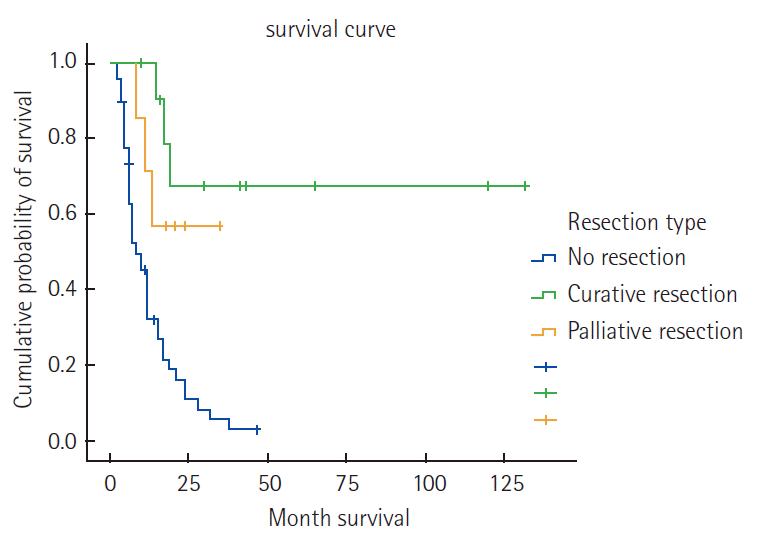
Unresectable or metastatic lesions were ascertained abdominal computed tomography (CT), positron emission tomography/CT and diagnostic laparoscopy. The factors of inoperability were 26 patients of peritoneal seeding, 8 tumor fixation, 7 mutiple liver metastasis, 15 multiple lymph node metastasis. They received TS-1/cisplatin regimen for primary chemotherapy. The response rates was 40.9% (18/44). The resection rate was 27.2% (12/44). Among 8 patients received curative resection and 4 received palliative resection. Median survival time were 41 months in cutative resection group, 21 months in palliative resection group and 8 months in non-resection group respectively (P=0.000).
Conclusion:
The response rates was 40.9% (18/44) and the resection rate was 27.2% (12/44). Resection group had longer survival than non-rescetion group. So aggressive treatment was needed to improve survival.
서 론
위암은 우리나라에서 호발하는 암으로 가장 높은 발생률과 세 번째로 높은 사망률을 보이는 암 질환이다. 최근 위내시경을 포함한 건강검진의 증가로 조기 위암으로 진단받는 환자들이 증가하고 있다. 위암은 조기에 진단될 경우 높은 완치율을 보이는 반면 병기가 진행됨에 따라 생존율이 확연히 낮아지는 경향을 보인다. 조기위암으로 진단 후 근치적 절제술을 시행받은 환자들은 5년 생존율이 90% 이상으로 요즘은 치료 후의 삶의 질을 고려하여 저침습적 치료를 시행하는 경우가 많다. 하지만 진행위암의 경우는 치료성적이 좋지 않다. 외과적 절제술과 체계적 림프절 절제술이 생존율 향상에 많은 기여를 하고 있지만[1] 최근의 여러 가지 phase III 연구들의 결과에서 여전히 좋지 않은 예후를 보이고 있고 중앙 생존기간이 9.2개월에서 13개월 밖에 되지 않았다[2-4]. 아직도 많은 환자들이 진행암으로 혹은 절제가 불가능한 위암으로 내원하게 되며 후자의 경우에 특히 예후가 불량하여 중앙생존기간이 8개월이 되지 않는 것으로 알려져 있다[5,6]. 특히 타 장기로 전이되거나 재발되었을 경우 수술적 방법으로는 근치가 어려우며 생존율은 더욱 낮아지게 된다. 최근 들어 항암치료에 대한 경험이 축적되면서 위암은 항암치료에 반응이 있는 것으로 받아들여지고 있으며, 그에 따라 항암치료는 수술 불가능한 진행성 위암에서 완화치료의 중요한 방법으로 널리 인정되고 있다[7]. 이에 저자들은 절제불가능 혹은 전이성 위암환자들을 대상으로 TS-1/Cisplatin (CDDP)를 이용한 일차화학요법 후의 반응률, 약물 부작용 및 절제율 등을 알아보기 위해 연구를 시행하였다.
방 법
2005년 1월부터 2012년 12월 사이에 치료받은 절제불가능 혹은 전이성 위암환자들 중 TS-1/CDDP 요법을 시행한 환자 44명을 대상으로 연구를 시행하였다. 본 연구의 적격조건은 조직학적으로 위 선암이 확인된 절제불가능 위암, 타장기 전이나 복막전이가 확인된 위암환자로서 선행화학요법 전 검사에서 일반 혈액검사상 혈색소 10.0 g/dL 이상, 백혈구 수 4,000/mm3 이상, 혈소판 수 100,000/mm3 이상, 혈청 빌리루빈치가 정상치의 두 배 이하, 혈청 transaminase치가 정상치의 두 배 이하, 혈청 creatinine치가 정상치 범위 이내이고 Eastern Cooperative Oncology Group performance status가 0-1인 경우였다. 절제불가능 위암은 인접 장기나 림프절로 종양의 직접 침윤이 있는 경우나 중요 혈관으로 침윤이 있는 국소진행암으로 정의하였다. TS-1은 40 mg bid/m2 (body surface area [BSA]< 1.25), 50 mg bid/m2 (1.25<BSA< 1.50), 60 mg bid/m2 (BSA> 1.50) 등으로 복용하였다. TS-1은 3주간 복용 후 2주간 휴약하고 CDDP는 60 mg/m2 용량으로 3일째 정맥 주사하는 것을 1주기로 하였다. 투여용량은 선행 치료 후 부작용의 발현 정도에 따라 증량 혹은 감량하였다. 치료에 대한 반응은 2회의 항암약물치료 후 전산화단층촬영 또는 양전자 방출단층촬영(positron emission tomography-computed tomography)을 시행한 후 2인의 방사선과 전문의의 판독소견을 World Health Organization 판정 기준에 따라 완전 반응(complete response), 부분 반응 (partial response), 안정 질환(stable disease) 및 진행성 질환(progressive disease)으로 분류하여 분석하였다. 부작용의 정도는 Common Terminology Criteria for Adverse Events (CTCAE) ver. 3에 따라 조사하였다. 생존율은 Kaplan-Meier 방법을 이용하여 구하고 log-rank test로 검정하였다. 통계처리는 SPSS ver. 15.0 (SPSS Inc., Chicago, IL, USA) 프로그램을 이용하였다.
결 과
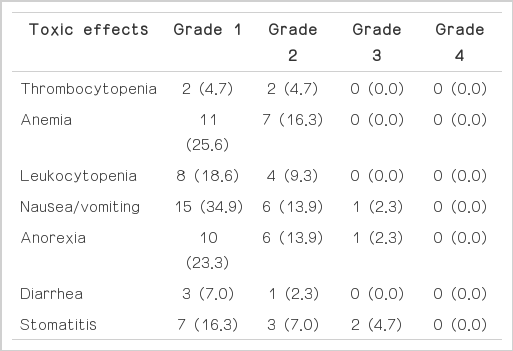
44명의 환자를 대상으로 일차화학요법 후의 반응률, 약물 부작용 및 절제율 등에 대해 조사하였다. 환자들의 임상병리학적 특성은(Table 1)과 같다. 남자가 29명, 여자가 15명이었고 평균연령은 56.3세였다. 미분화암이 많았고 원발암의 위치는 중하부가 많았다. 근치적절제술이 불가능한 원인으로 복막 전이가 26명, 원발암이 고정되어 있어 절제가 불가능했던 경우가 8명, 다발성 간전이가 7명, 그리고 절제범위를 벗어난 다발성 림프절 전이가 15명이었다(Table 2). 치료 횟수의 중앙치는 4.4회 였고 Response Evaluation Criteria in Solid Tumors (RECIST) ver. 1.1 기준에 의한 완전 반응을 보인 환자는 없었으며 부분 반응이 18명(40.9%)의 환자에서 관찰되었고 진행성 질환은 16명(36.4%)의 환자에서 발생하였으며 나머지 10명(22.7%)에서는 안정 질환으로 확인되었다(Table 3). 부분 반응을 보인 환자 18명을 대상으로 진단적 복강경을 시행한 후 절제가 가능해 보인 환자는 개복술을 시행하였다. 6명은 절제술이 불가능하였고 4명(9.1%)은 고식적 절제술을, 8명(18.2%)은 근치적 절제술을 시행하였다. 근치적절제술을 시행한 8명에서 일차화학요법 전 근치적 절제술이 불가능한 원인은 복막전이가 2명, 원발암의 고정으로 절제 불가능한 경우가 2명, 다발성 림프절 전이가 3명, 복막전이와 원발암의 고정이 동반된 경우가 1명이었으며, 병리학적 병기는 stage IB 2명, stage IIA 2명, stage IIB 2명, stage IIIB 1명, 그리고 stage IIIC 1명이었다(Table 4). 이들의 비절제군, 고식적 절제군과 근치적 절제군의 생존율은 통계적으로 유의한 차이를 보였다(Fig. 1). 비절제군, 고식적 절제군과 근치적 절제군의 중앙생존기간은 각각 8개월, 21개월, 41개월이었다(P=0.000). CTCAE ver. 3에 따른 부작용 평가의 경우 혈액학적 부작용으로 빈혈, 백혈구 감소, 혈소판 감소 등이 있었고, 비혈액학적 부작용으로 오심/구토, 식욕부진, 설사, 구내염 등이 있었다. 종류와 발현빈도는 Table 5와 같다. 1, 2등급의 빈혈, 백혈구 감소, 혈소판 감소가 각각 18명, 12명, 4명이 있었고, 각각 1명, 1명, 2명의 3등급의 부작용을 보인 오심/구토, 식욕부진, 구내염환자에서는 그 다음 치료부터 항암제의 용량을 조절하였다.

Clinicopathological characteristics in unresectable or metastatic gastric cancer patients who received TS-1/CDDP
고 찰
조기위암 환자는 빠른 진단과 근치적인 수술이 예후를 향상시킬 수 있다. 하지만 Bonenkamp 등[8]은 진행위암환자에서 수술만으로는 암병소의 절제로 병의 국소적 조절에는 도움이 되지만 환자들의 생존율 향상은 기대할 수 없다고 하였고, Kodera 등[9]은 진행 위암환자에서 대동맥 주위 림프절 곽청술의 시행은 환자의 예후에 큰 도움이 안 된다고 보고하였다. 반면에 Newman 등[10]은 보조항암화학요법은 림프절 전이가 있는 환자에서 생존율의 향상을 보인다고 보고하였고 Barone 등[11]은 신보강화학요법(neoadjuvant chemotherapy)은 원발병소와 림프절 전이의 병기를 내리는 효과가 있으며 신보강화학요법 후 절제술의 근치도를 높이는 효과가 있다고 하였지만 많은 보고에서 의미 있는 생존율의 향상은 없다고 하였다. 그럼에도 불구하고 최근에 여러 가지 항암제들이 위암환자에서 좋은 임상반응을 보이고 있다.
진행성 위암 환자에서 항암치료가 최적 지지요법에 비하여 생존율을 향상시킨다는 보고가 있다[12]. 절제불가능 혹은 전이성 위암 환자들의 치료를 위해 fluoropyrimidine (5-FU, S-1, or capecitabine), platinum (cisplatin or oxalipatin), taxane (docetaxel or paclitaxel), epirubicin, irinotecan 등 여러 가지 약제를 이용한 단독 혹은 병합 요법의 항암치료가 시행되고 있고 메타분석에서 병합요법이 생존율을 좀 더 높인다는 보고가 있다[13]. 한국이나 일본에서는 fluoropyrimidine과 cisplatin을 이용한 두 가지 약제 병용요법 치료를 시행하였고, capecitabine이나 S-1이 5-FU의 지속적인 주입을 대신해서 사용되고 있다[4,14]. 본 연구에서 S-1과 cisplatin을 이용한 항암치료를 시행하였고, RECIST ver. 1.1 기준에 의해 평가한 결과 완전 반응은 없었으며 부분 반응이 18명(40.9%)의 환자에서 관찰되어 반응률은 40.9%를 보였다. 진행성 위암환자에 S-1과 cisplatin을 이용하여 항암 치료를 시행한 다른 연구[4]에서도 완전 반응 2%, 부분 반응 39%를 보여 반응률은 41% 정도로 본 연구와 비슷하였다. 그리고 진행성 위암에 다른 항암제들을 사용한 연구들에서도 반응률이 40%에서 45% 정도로 나와 반응률의 차이는 없었다[15-17]. 절제 불가능한 진행성 위암환자에서 일차화학요법을 시행한 후 수술을 시행한 결과를 발표한 연구[18]에서 50% (17/34명)의 반응률을 보였고 15명(44.1%)의 환자에서 근치적 절제술을 그리고 5명(14.7%)은 고식적절제술을 시행하였다고 보고하였다. 수술을 시행 받은 군이 수술을 시행하지 못하고 항암치료만 받은 군보다 생존율이 통계적으로 의미 있게 높았고(P<0.02), 수술 시행 군 중에서 근치적 절제술을 받은 군이 고식적 절제술을 받은 군보다 생존율이 통계적으로 의미 있게 높았다(P<0.02). 본 연구에서는 부분 반응을 보인 환자 18명 중 8명(18.2%)은 근치적 절제술을, 4명(9.1%)은 고식적 절제술을 시행하였고 고식적 절제를 포함한 절제율은 27.3% 정도 되었다. 나머지 환자 6명은 절제가 불가능하였다. 비절제군, 고식적 절제군과 근치적 절제군의 생존율은 통계적으로 유의한 차이를 보였다. 비절제군, 고식적 절제군과 근치적 절제군의 중앙생존기간은 각각 8개월, 21개월, 41개월이었다(P=0.000). 비록 절제율이 27.3% 밖에 되지 않았고 근치적 절제율은 18.2%에 불과했지만 일차화학요법에 반응을 보이는 경우 적극적인 수술적 치료를 시행한다면 생존율을 증가시킬 수 있다고 생각된다. 항암치료 시행 후 CTCAE ver. 3에 따른 부작용 평가를 시행하였는데 혈액학적 부작용으로는 빈혈이 41.9%로 가장 많았고 백혈구 감소, 혈소판 감소 등의 순서로 발현이 되었지만 grade 3, 4의 부작용은 없었다. 비혈액학적 부작용으로는 오심/구토가 48.8%로 거의 절반의 환자에서 있었고 식욕부진, 구내염, 설사 등의 순서로 발현이 되었으며 grade 3의 부작용으로 오심/구토와 식욕 부진 그리고 구내염이 있었다. 이들 환자에서는 그 다음 치료부터 항암제의 용량을 조절하였다. 국내의 다른 연구[19]와 비교하였을 때 부작용의 발현 비율은 큰 차이가 없었는데 서구의 환자들을 대상으로 항암치료 연구 결과를 발표한 Ajani 등[20]의 연구에서 항암치료 후의 독성평가 결과 본 연구와 비교하면 grade 3 이상의 독성의 발현율이 높은데, S-1은 25 mg/m2로 하루에 두 번 21일간 복용하고 cisplatin은 75 mg/m2로 첫날 사용하였는데 cisplatin의 용량이 많은 것과 연관이 있어 보인다.
위암은 초기에 발견하여 치료하면 좋은 예후와 결과를 보이는 반면에 절제가 불가능한 진행성 위암인 경우 예후가 불량하고 생존율이 많이 낮아지게 된다. 진행성 위암의 치료를 위해 여러 가지 항암제가 개발되었고 단독 혹은 병합요법을 사용하여 효과를 높이려는 시도를 하고 있다. TS-1/CDDP 병합요법을 이용한 항암치료도 한 가지 방법으로 절제불가능 혹은 전이성 위암환자들을 대상으로 치료한 결과 반응률, 항암치료 후 절제율 등에서 다른 연구와 별 차이 없는 결과를 보였고 약물 부작용은 높지 않아 일차화학요법으로 비교적 안전하게 사용할 수 있는 항암제 병합요법이라 생각되고 항암치료 후 적극적인 절제술을 시행한다면 생존율을 높일 수 있다 하겠다.
Notes
No potential conflict of interest relevant to this article was reported.