자기공명영상 기반의 임상병기 T3N0 직장암 환자에서 수술 전 항암방사선 치료의 무작위적 사용은 적절한가?
Is preoperative chemoradiotherapy warranted in magnetic resonance imaging-based clinically T3N0 rectal cancer?
Article information
Trans Abstract
Purpose:
Preoperative chemoradiotherapy (PCRT) has been widely adopted. However, benefit of PCRT for patients with clinically T3N0 (cT3N0) rectal cancer is doubtful. We analyzed oncologic outcome in patients with magnetic resonance image (MRI) staged cT3N0 rectal cancer according to receipt of PCRT.
Methods:
Between January 2006 and December 2010, one hundred twenty four patients were MRI-based T3N0 rectal cancer. In patients who received PCRT the median dose of given radiotherapy was 5,040 Gy, and either 5-fluorouracil/leucovorin, capecitabine or S-1/oxaliplatin was delivered. The 3-year disease free survival rate (DFS) and sphincter preservation were compared.
Results:
Sixty four patients received and sixty patients did not receive PCRT. Rate of complete remission was obtained in 17.2% of PCRT group. Sphincter-preserving surgery was performed in 79.7% of PCRT group and 88.3% of non-PCRT group (P=0.194). In patients with low-lying rectal cancer, sphincter-preservation was also not different; PCRT 70.5% and non-PCRT 66.7% (P=0.761). Overall recurrence occurred in 21.9% in PCRT group and 15.0% in non-PCRT group (P=0.327). Three-year DFS was comparable between PCRT (76.5%) and non-PCRT group (79.7%) (P=0.330).
Conclusion:
Preoperative chemoradiotherapy in MRI-based cT3N0 rectal cancer had no benefit on sphincter preservation and did not improve DFS. Therefore, the routine use of PCRT in cT3N0 rectal cancer should not be warranted.
서 론
지난 20여 년간 직장암의 치료에는 많은 변화가 있어왔다. 1980–90년대 근치적으로 절제된 직장암의 경우 수술 후 Fluorouracil 기반의 항암방사선 치료가 국소 재발률을 낮추고 생존율을 향상 시킨다는 연구 결과가 제시되었다. 이와 더불어 그 외 여러 연구를 바탕으로 1990년 미국국립보건원(National Institutes of Health)는 2기 혹은 3기 직장암에서 수술 후 항암방사선치료를 표준 치료로 추천하였다[1-3]. 그러나 T3N0병기 환자들의 경우, 전직장간막절제술의 도입 이후 수술만 시행한 경우에도 낮은 국소 재발률과 높은 생존율이 보고되어 왔으며[4,5], 따라서 적절한 수술적 치료가 시행되었을 때 T3N0 환자에 있어 수술 후 항암방사선치료의 필요성에 대한 논란이 제기되었다.
2000년대 중반 이후 진행성 직장암의 치료에 있어 수술 전 항암방사선치료가 수술 후 항암방사선치료에 비해 괄약근 보존율을 증가시키며 국소 재발률을 감소시키고 방사선치료에 의한 독성을 줄일 수 있는 장점이 있다는 연구 결과들이 발표되며, 현재 수술 전 항암방사선치료가 국소적 진행성 직장암의 표준 치료의 하나로 자리잡았다[6-8]. 그러나 임상병기가 정확하다고 가정할 경우, 전직장간막절제술만으로도 좋은 종양학적 결과를 얻을 수 있는 T3N0 환자에게 모두 수술 전 항암방사선치료를 시행하는 것이 적절한지에 대해서는 의문이 여전히 남아있다.
현재까지의 연구는 임상병기 T3N0 환자를 대상으로 수술 전 항암방사선 치료를 시행한 후 진단되는 전이성 림프절의 존재에 초점을 맞추며, 이 경우 수술 전 항암방사선 치료를 시행하지 않을 경우 적절한 치료가 생략되는 결과를 초래하게 된다는 주장에 대개 초점이 맞추어져 있었다[9,10]. 그러나 실제로 임상병기 T3N0 직장암 환자에서 수술 전 항암방사선 치료를 시행한 경우와 그렇지 않은 경우에 재발, 생존율, 및 괄약근 보존에 있어 어떤 차이가 있는지를 직접 비교한 연구는 많지 않다. 따라서, 본 연구에서는 자기공명영상(magnetic resonance imaging, MRI)상 T3N0의 임상병기로 진단된 국소적으로 진행된 직장암 환자에서 수술 전 항암방사선치료를 했는지 여부에 따라 종양학적 결과와 괄약근 보존에 차이가 있는지를 비교하여 이 환자군에서 수술 전 항암방사선을 모두 시행하는 것이 정당한지에 대해 생각해 보고자 하였다.
방 법
대상 환자
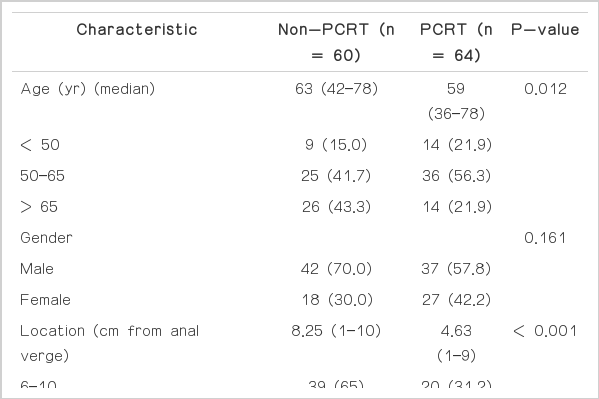
2006년 1월부터 2010년 12월까지 서울아산병원에서 수술 전 MRI를 통해 임상병기 T3N0로 진단받은 중, 하부 직장선암 환자 124명을 대상으로 하였다. 중, 하부 직장암은 종양의 원위연이 항문연에서 10 cm 이내에 위치한 경우로 정의했다. 선암이 아닌 다른 조직형의 종양이거나 이전에 방사선치료나 화학요법을 받은 경험이 있는 경우, 유전성 비용종증 대장암인 경우, 수술 전 MRI를 시행하지 않은 경우, 국소절제술을 시행받은 경우, 측방림프절 절제술을 동반 시행한 경우, 진단 당시에 원격전이가 있는 경우, 동시성 대장암이 있는 경우, 타장기의 원발 종양을 동반한 경우, 수술 후 조직학적 진단을 확인할 수 없는 경우는 제외했다. 항암방사선요법 결정 전 검사로는 병력청취, 이학적 검사, complete blood count, 혈청화학검사, 혈청 암태아성항원치, 흉부방사선 촬영, 대장내시경, 복부 컴퓨터 단층촬영, 필요에 따라 positron emission tomography (PET)/PETcomputed tomography (CT)를 시행했다. 수술 전 항암방사선 치료 여부는 의료진의 선호도에 의하거나 수술 전 항암방사선 치료 시행에 대한 설명 후 환자의 선택에 의해 결정했다. 대상환자 중 수술 전 항암방사선 치료를 시행받은 경우(preoperative chemoradiotherapy, PCRT군)는 64예, 시행받지 않은 경우(non-PCRT군)는 60예였다.
임상병기 결정, 수술 전 항암방사선 치료 및 수술, 추적관찰
임상병기 결정을 위해 gadolinium-enhanced MRI를 시행하였고 T1-, T2-weighted fast-spin echo sequence에 따라 관상면, 시상면, 수평면 이미지를 획득하였다. 종양 침범의 깊이, 림프절 전이, 직장간막의 침범 정도를 판독하였고 종양이 근육층을 지나 직장주위 지방조직까지 침범된 신호 강도를 보일 경우 T3 병변으로 진단하였다. 림프절 전이 여부는 림프절이 장경 5 mm 이상이면서 지방림프절기문(fatty hylum)을 보이지 않거나, 림프절 경계가 불규칙한 모양 또는 비균질한 구조(heterogeneous texture)를 보일 경우 림프절 전이가 있는 것으로 판단했다. 모든 환자의 MRI는 한 명의 영상의학전문의가 이전의 MRI 임상병기와 환자 임상병리정보를 모르는 상태에서 재판독하였다.
수술 전 항암방사선 치료를 시행한 경우, 방사선 치료는 3 또는 4-field technique으로 1회당 1.8–2.0 Gy의 방사선을 총 28회로 5,040 Gy를 조사하였다. 항암화학요법은 14예에서 5-fluorouracil (375 mg/m2)와 leucovorin (20 mg/m2)의 항암제를 방사선 치료 전후 3일 간 bolus로 정주하여 2차례 시행하였고, 44예에서 capecitabine (1,650 mg/m2/day)을 2회 분복하여 치료기간 동안 경구 복용했다. 6예에서 S-1/oxaliplatin을 투약하였다. 항암화학요법제는 환자의 편의성과 치료자의 선호도에 따라 결정이 되었다. 수술은 방사선 치료 종료 후 5–8주에 시행했으며, 전 예에서 총 직장간막절제술과 자율신경보존술을 시행했다.
수술 후 추적관찰은 이학적 검사, 혈청암태아성항원치 검사를 3–6개월 간격으로 시행하였고, 복부 및 흉부 CT 또는 흉부 X-선 검사를 6–12개월 간격으로 시행하였으며, 수술 후 6–12개월에 대장내시경을 시행한 후 2–3년 간격으로 시행했다.
통계 검정
치료 방법에 따라 분류된 양 군의 임상병리학적 요소를 비교했다. 양 군 간의 비모수적 항목은 Wilcoxon rank sum test로 비교했으며, 범주형 항목은 각 군에서 빈도에 따라 요약하고 chi-square test에 의해 비교했다. 무병생존율은 Kaplan-Meier 법으로 결정했으며 logrank test로 각 군 간의 무병생존율을 비교했다. 다변량 분석을 위해 Cox proportional hazard regression model을 이용했으며, 유의수준은 P<0.05였다(SPSS ver. 21.0, IBM Co., Armonk, NY, USA).
결 과
환자 군의 임상병리학적 특징
대상 환자는 총 124명이었으며 평균 연령은 59세(범위, 36–78세)였고 남녀 비는 79:45로 남자가 많았다. 하부직장암은 65예(52.4%), 중 부직장암은 59예(47.6%)였으며 104예(83.9%)에서 괄약근 보존술식이 가능하였다. 124명 중 64명(51.6%)의 환자에서 수술 전 항암방사선치료를 시행하였다. 방사선 치료 전 평균 혈청 암태아성항원치는 2.35 (범위, 0.4–42.1)이었다. 환자들의 평균 추적관찰 기간은 50개월 (범위, 1–89개월)이었다.
수술 전 항암방사선 치료 여부에 따라 차이를 살펴보았을 때, PCRT군의 환자 연령이 유의하게 낮았다. PCRT군에서 하부직장암 44예(68.8%)이 non-PCRT군 21예(35%)보다 유의하게 많았다(P<0.001). 괄약근 보존술을 시행한 비율은 양 군 간에 차이가 없었으며(P=0.194), 하부직장암 환자만을 고려했을 경우도 괄약근 보존술식 시행 비율은 수술 전 항암방사선 치료 여부에 따라서 유의한 차이를 보이지 않았다(P=0.761). 획득림프절의 수는 PCRT군에서 유의하게 적었으며, 림프혈관침범, 신경주위조직 침범은 non-PCRT군에서 더 많았다(Table 1).
방사선 화학요법 전 검사의 정확성
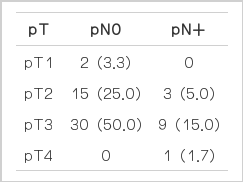
수술 전 항암방사선치료를 받지 않은 non-PCRT군에서 수술 후 T3N0를 보인 경우는 30예로 50% 이하의 정확성을 보였다. 임상병기가 과진단 된 경우는 17예(28.3%) 였으며, 림프절 전이를 진단하지 못한 경우는 13예(21.7%)였다(Table 2).
수술 전 항암방사선치료를 시행한 64예의 환자 중 11예(17.2%)에서 병리학적 완전 관해를 보였다. PCRT군에서 병기가 감소된 경우는 모두 37예(57.8%) 였으나, 치료 후에도 림프절 전이가 진단된 경우는 12.5%였다.
재발 및 무병생존율
Non-PCRT군에서 수술 후 항암치료를 시행한 경우는 52예(86.7%), 보조적 방사선 치료를 시행한 경우는 12예(20%)였으며, PCRT군에서 수술 후 항암치료를 시행한 경우는 62예(96.9%)였다. 추적관찰 기간 동안 124명의 환자 중 23명(18.5%)에서 재발하였으며 non-PCRT군에서 9명(15.0%), PCRT군에서 14명(21.9%)의 재발이 발견되었다. 전신 재발은 모두 23예에서 발생했고, PCRT군에서 14예(60.9%), non-PCRT군에서 9예(39.1%) 발생했다. 가장 흔한 재발부위는 폐 전이로 15예에서 발생했다. 국소재발은 PCRT군에서 1예(4.3%) 발생했으며 PCRT여부에 따라 유의미한 차이를 보이지 않았다(P=0.327).
3년 무병생존율은 PCRT군에서 76.5%, non-PCRT군에서 79.7%로 양 군 간의 유의한 차이는 보이지 않았다(P=0.330) (Fig. 1). 무병생존율에 영향을 미치는 인자에 대해 다변량 분석을 시행했다(Table 3). 치료 전 혈청 암태아성항원치가 높은 경우 3년 무병생존율 감소와 유의한 상관관계를 갖는 것으로 나타났다. 그러나 수술 전 항암방사선치료의 시행 여부는 무병생존율과 유의한 관계를 보이지 않았다.
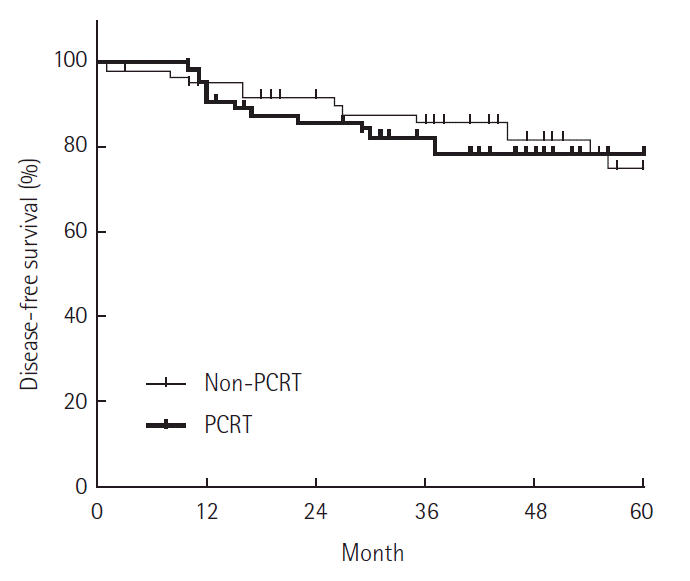
Rates of 3-year disease free survival in the population of 124 eligible patients, according to preoperative chemoradiotherapy (PCRT) group. At three years, the rate of disease free survival had no significant difference between PCRT group and non-PCRT group; 76.5% and 79.7%, respectively (P=0.330).
고 찰
본 연구에서는 clinically T3N0 (cT3N0)의 중, 하부 직장암 환자에서 수술 전 항암방사선치료 cT3N0 시행 여부에 따라 괄약근 보존율과 3년 무병생존율에 차이를 보이지 않았다.
T3N0 병기의 직장암 환자는 재발 위험도가 “중등도 위험군 (intermediate risk)”으로 분류되고 있으며, 이 경우 항암방사선치료의 시행이 모두 권장되지는 않는다[11]. 실제로 T3N0 병기의 직장암 환자에서 적절한 수술적 절제 이후 4.1%–8%의 낮은 국소재발률을 보여[12,13] 수술 후 방사선치료의 필요성에 대해 논쟁이 있어 왔으며[14,15], 직장암 치료에서 PCRT가 표준치료의 하나로 자리잡으면서 임상병기 T3N0 직장암 환자에서 PCRT를 적용하는 데에 대한 의문도 함께 생겨났다. 최근의 연구들은 cT3N0의 수술 후 병기를 바탕으로 PCRT를 실시하지 않는다면 잠재적으로 치료가 축소되었을 가능성이 있었던 병기 평가가 절하된 환자의 빈도를 조사하는 데 초점이 맞춰져 있다. 경직장초음파(endorectal ultrasonography, ERUS), MRI로 진단한 188명의 cT3N0 환자를 대상으로 한 후향적 다기관 연구에서, PCRT를 시행한 후에도 22%의 환자에서 림프절 전이가 발견된다는 결과를 보고하며, 이 환자들에서 저치료의 가능성이 있어 이 환자 군에서 PCRT를 시행하는 것이 필요하다고 주장하였다[9]. 최근 ERUS, CT, PET, MRI를 바탕으로 진단한 32명의 PCRT를 받은 cT3N0 환자를 대상으로 시행한 연구에서는 28%가 수술 후 병리학적으로 림프절 전이가 진단되었다고 보고하여 이런 주장을 뒷받침 해주었다. 그러나 한편으로는 T3N0 환자 중 측방절제연(circumferential resection margin)의 침윤이 없는 경우와 중, 상부 직장암인 경우의 환자에 있어서는 PCRT가 과잉치료가 될 수도 있었다고 주장했다[10]. 이러한 연구들은 모두 수술 전 임상병기의 저평가 위험도를 PCRT가 필요한 근거로 삼고 있다. 그러나 임상병기 저평가의 위험이 있다면 과평가의 위험도 또한 함께 존재하고 있음을 고려할 필요가 있다. German Rectal Cancer Trial에서는 T3 혹은 림프절 전이 양성 환자를 무작위 배정하여 수술적 치료만 시행한 군의 18%에서 수술 후 병리학적으로 1기로 진단되어 과평가의 가능성 또한 있음을 보였다[8].
PCRT의 대상을 결정하는 데에는 임상병기 결정의 정확성이 중요하다. ERUS의 T병기 결정의 정확도는 69%–97% 사이로 폭넓게 보고되고 있는데, 종괴가 크고 고침습성인 경우, 상부 직장암인 경우에는 적정 병기 평가가 어렵고 과대평가 되는 경향이 있다[16,17]. 직장 MRI 검사는 고식적 영상 기법일 경우 59%–88%, 경직장 코일을 사용한 경우 71%–91%의 정확성을 보이며 초기 T3 병기와 T2 병기의 구별이 어렵다[18,19]. CT의 T병기 진단 성적은 비진행성 직장암일 경우 52%–74%, 진행성 직장암일 경우 79%–94%로, ERUS나 MRI 진단 성적에 못 미치는 결과를 보인다[20,21]. 여러 진단 기법의 림프절 전이 여부 진단의 정확도는 여전히 만족스럽지 못한 수준인데 CT에서는 22%–73% 정도의 낮은 결과를 보이며[22,23], ERUS는 62%–83% 정도로 초음파 해상력의 한계로 인해 근접한 림프절만 평가가 가능하다는 제한점을 갖고 있다. 직장 MRI에서는 39%–95%로 연구결과에 따라 큰 차이를 보이고 있다[24]. 본 연구에서는 MRI 병기만을 고려하여 단일 진단 기법만으로 수술 전 병기 결정을 하였고 한 명의 영상의학전문의가 임상정보에 눈가림상태로 재판독을 시행하여 연구자 간 발생할 수 있는 차이, 임상정보의 인지로 발생할 수 있는 편견을 배제하여 가능한 동일한 조건의 환자에서 PCRT 여부에 따른 결과를 비교했다.
PCRT를 통해 종양을 줄임으로써 괄약근 보존율이 좀 더 증가할 것을 일반적으로 기대하게 된다[25,26]. PCRT가 괄약근 보존 빈도를 높이는지에 대해서는 현재까지도 통일된 의견은 없다. 대표적인 무작위 배정 연구에서도 상반된 결과를 보이고 있는데, German Rectal Cancer Study Group에 따르면 799명의 T3 혹은 T4 또는 림프절 양성의 직장암 환자들 전체 군에서 PCRT 여부에 따라 괄약근 보존율은 차이가 없었지만, 외과의사에 의해 치료 전 경직장초음파가 필요하다고 판단되었던 194명의 환자 군에서는 PCRT를 받은 군에서 괄약근 보존율이 통계학적으로 유의하게 높았다(PCRT, 39%; post CRT, 19%; P=0.004) [8]. 그러나 National Surgical Adjuvant Breast and Bowel Project R-03 연구에서는 외과의의 전향적 판단으로 수술 방법을 결정하였을 때 괄약근 보존 빈도는 PCRT 여부에 따른 차이를 보이지 않았다(PCRT, 47.8%; post CRT, 39.2%; P=0.277) [27]. 항문연에서 1–6 cm의 T3 하부직장암 환자 85명을 대상으로 한 중국의 연구는 PCRT가 종양의 병기를 낮추고 괄약근 보존의 비율을 높일 수 있다는 결과를 발표하였으며[28], 137명의 임상 병기 T3N0 직장암 환자만을 대상으로 한 연구에서는 PCRT군에서 종양의 병기는 유의미하게 감소하였으나 5 cm 이하의 하부직장암에서는 PCRT여부가 괄약근 보존에 영향을 미치지 않는다고 보고하였다(P=0.14)[29]. 본 연구는 MRI 기반 임상병기 T3N0 환자들에서 PCRT를 시행하는 것이 괄약근 보존에 이점이 없음을 보이고 있다. 특히 PCRT 시행 비율이 높은 하부직장암만을 비교하였을 때도 양 군 간의 유의한 차이를 보이지 않아, 임상병기 T3N0 직장암 환자에서는 종양의 위치에 관계없이 PCRT가 괄약근 보존에 유리한 영향을 미치는지에 의문을 제기한다. 그러나 괄약근 보존에는 이 외에도 환자의 체형, 수술자의 경험, 환자의 열망, 연령 등 다양한 요소가 관여하게 되므로 PCRT의 영향을 단정적으로 제시하기는 어렵다.
본 연구에서는 PCRT여부에 따라 3년 무병생존율 및 전신재발률에도 차이를 보이지 않았다. 대상군에서는 국소 재발의 절대적 발생 수가 적어 차이를 비교하기 어려운 점이 있으나 국소재발에도 차이를 발견할 수 없었다. PCRT군 중 17.2%에서 병리학적 완전 관해가 있었고 상당수에서 병기 감소가 나타났음에도 불구하고 재발률과 무병생존율을 통해 본 치료 성적에서 PCRT의 우월성을 입증하지 못하였다. 반면, PCRT를 시행하지 않은 군에서는 13.3%에서 수술 후 항암치료를 시행하지 않았고, 80%의 환자는 수술 후 방사선 치료를 시행하지 않았음에도 PCRT를 시행한 군과 차이가 없는 종양학적 결과를 보이고 있다. 따라서 임상병기 T3N0 직장암에서 종양학적 결과의 관점에서 볼 때 PCRT의 이득은 분명하다고 할 수 없다.
본 연구는 후향적 연구로 PCRT 대상군을 선정하는데 있어 그 적응증이 분명치 않았다는 제한점을 가지고 있으며, 대상환자 수가 작고 추적기간이 짧은 단점이 있다. 양 군의 구성 또한 연령과 직장암의 위치에서 유의한 차이가 있어 양 군이 동일한 조건 하에서 비교되지 못했다는 한계점이 있다. 또한 MRI 기반 임상병기만을 바탕으로 환자군을 구분하였기 때문에, 임상병기로 수량화 되지 않은 예후에 불리하게 작용할 수 있는 요소가 있는 환자들이 PCRT군에 더 포함되었을 가능성을 배제할 수 없다.
그러나, 기존의 연구들이 수술 전 임상병기를 진단하는데 있어 CT, MRI, ERUS 및 PET/PET-CT의 다양한 방법을 혼재하여 포함한 반면, 본 연구는 현재 가장 임상적으로 종양의 침범 정도와 림프절 전이를 진단하는데 있어 가장 신뢰할 수 있는 MRI 단일 진단법을 바탕으로 국소병기를 평가한 환자만을 포함하여 진단 방법의 이질화에서 오는 부정확성을 줄이고자 하였다. 또한 본 연구는 같은 임상병기의 환자에서 PCRT를 시행한 군과 시행하지 않은 군의 환자를 직접 비교하여, PCRT군만을 대상으로 수술 후 병기 결과를 바탕으로 치료 효과를 추정하지 않고 직접적인 치료 결과의 차이를 보여주었다는 데에 의미가 있다.
본 연구는 임상병기 T3N0 중, 하부의 직장암 환자에서 PCRT의 시행이 종양학적 결과나 괄약근 보존에 유익한 영향을 줄 수 있는지에 대해 의문을 제시한다. 그러나 임상병기의 정확한 진단 및 수량화 되기 어려운 예후인자에 대한 선별이 우선되어야 치료 효과를 보다 효과적으로 비교할 수 있을 것이다. 따라서 향후 임상병기 T3N0 환자에서 수술 전 항암방사선치료의 영향을 비교하기 위한 대규모의 연구뿐 아니라, 적절한 대상자 선정을 위한 임상병기 진단 방법에 연구가 필요할 것으로 생각된다. 또한 임상병기 외에 수술 전 항암방사선 치료에 좋은 반응을 보이는 환자를 예측할 수 있는 방법에 대한 연구가 동반되어, 임상병기 진단의 한계에 대한 대안이 제시되어야 할 것이다.
Notes
No potential conflict of interest relevant to this article was reported.